База электронных химических библиотек - http://chemistry-chemists.com/Libraries.html
2. Справочник химика – http: //www.chem100.ru/ 3. Периодическая таблица – http: //www.chemport.ru/pertable/ 4. Электрохимический ряд напряжений металлов – http: //chemister.da.ru/Chemie/electrohimicheskii-rad.htm Интернет-ресурсы: 1. Электронная библиотека сайта " Chemnet" – http: //www.chem.msu.su/rus/elibrary/welcome.html 2. Неорганическая химия - 3.Химический портал – http: //www.chemport.ru/ 4.Основы химии. Электронный учебник – http: //www.hemi.nsu.ru/ 5.Химическая информационная сеть – http: //www.chemnet.ru/ 6.Самотестирование – http: //ido.tsu.ru/schools/chem/data/res/neorg/uchpos/ КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Тема 1. Основные понятия в химии Сведения об атомах и молекулах объединяются в атомно-молекулярное учение. Атомно-молекулярное учение — это первое учение о строении вещества, основные положения которого были разработаны М.В.Ломоносовым и в дальнейшем развиты в работах Джона Дальтона и Амедео Авогадро. Атомно-молекулярное учение дает объяснение основным понятиям и законам химии. Атом — электронейтральная система, состоящая из элементарных частиц. Химический элемент — вид атомов, характеризующихся одинаковым зарядом ядра. Молекула — устойчивая совокупность атомов, удерживаемых силами притяжения (химическими связями). Масса атома (mа(Х)) выражается в килограммах, граммах: mа(Н) = 1, 67·10-27 кг, или 1, 67·10-24 г; mа(О) = 2, 67·10-26 кг, или 2, 67·10-23 г. Пользоваться такими числами при расчетах неудобно. Поэтому применяют не абсолютные значения масс атомов, а относительные. За единицу атомной массы в химии и физике принята атомная единица массы. Атомная единица массы (а.е.м.) — 1/12 массы атома изотопа углерода 12С: 1 а.е.м.. = 1/12 Относительная атомная масса (Аr) — величина, равная отношению средней массы атома естественного изотопического состава (mа(Х)) к атомной единице массы (а.е.м.): Ar(X) = Относительная молекулярная масса (Мr(Х)) — величина, равная отношению средней массы молекулы естественного изотопического состава вещества к атомной единице массы: Мr(Х) = Таким образом, относительная атомная и молекулярная массы показывают, во сколько раз масса атома данного элемента и масса молекулы данного вещества больше одной а.е.м. Моль (v) — количество вещества, содержащее столько структурных частиц атомов, молекул, ионов и других частиц, сколько атомов содержится в углероде 12С массой 0, 012 кг. Количество вещества системы, содержащей 6, 02·1023 атомов или 6, 02·1023 молекул (или других структурных частиц), представляет собой моль этой системы. Число частиц в моле любого вещества называется постоянной Авогадро и обозначается NA: NA = 6, 02·1023структурных единиц/моль. Молярная масса (М) вещества X равна отношению массы (m) вещества к соответствующему количеству вещества (v): М(Х) = Молярная масса устанавливает связь между количеством вещества и его массой и обозначается кг/моль или г/моль. Например, M(NaOH) = Молярная масса численно равна относительной молекулярной массе. Например, М(О2) = 32 г/моль; Мr(О2) = 32. Молярный объем (Vm) — это отношение объема газообразного вещества к количеству вещества в этом объеме при любых условиях:
При нормальных условиях (н.у.) объем 1 моль любого газа равен 22, 4 дм3. Постоянная Относительная плотность газов (D) — это отношение масс равных объемов различных газов при одинаковых условиях (Р, Т одинаковы для обоих газов):
При этих условиях, согласно закону Авогадро, в данных газах содержится одинаковое число молекул. Но массы взятых газов окажутся неодинаковыми, следовательно, они будут относиться друг к другу как их молярные массы:
Если плотность измерена по водороду Пример 1. Какое количество вещества оксида меди (II) содержится в 120 г его массы? Решение: Относительная молекулярная масса Mr(CuO) = 64 + 16 = 80, следовательно, молярная масса M(CuO) = 80 г/моль. Пользуясь соотношением М = m/v, находим количество вещества:
Пример 2. Сколько молекул содержится в оксиде железа (III) массой 80 г? Решение. Молярная масса вещества равна M(Fe2O3) = 2·56 + 3·16 = 160 г/моль. Определяем количество вещества Fe2O3 в 80 г оксида:
Исходя из того, что 1 моль любого вещества содержит 6·1023 структурных единиц, находим число молекул в 0, 5 моль оксида железа (III): 0, 5·6·1023 = 3·1023. Для расчетов объемов газов используются закон Авогадро и следствия из него. Закон Авогадро формулируется следующим образом: В равных объемах газов при одних и тех же условиях содержится одинаковое число молекул. Для определения объема газообразных веществ используют молярный объем Vm. Пример 3. Определите объем сернистого газа SO2 массой 16 г при нормальных условиях. Решение. Молярная масса M(SO2) = 64 г/моль, что составляет 16 г: 64 г/моль = 0, 25 моль V = Vmv, откуда V = 22, 4 л/моль·0, 25 моль = 5, 6 л. Пример 4. Масса азота объемом 1 дм3 при нормальных условиях равна 1, 25 г. Определите относительную молекулярную массу азота. Решение. На основании следствия из закона Авогадро находим массу 22, 4 л N2: 1 л N2 — 1, 25 г 22, 4» N2 — х»
Молярная масса азота составляет
Пример 5. Относительная плотность хлора по воздуху равна 2, 448. Рассчитайте молярную массу хлора. Решение. М(возд) = 29 г/моль; DВОЗД(Сl2) = 2, 448; М(С12) = 29 г/моль·2, 448 = 71 г/моль
|

 =1, 667·10-24 г
=1, 667·10-24 г ; Ar(O) =
; Ar(O) = 
 ; Мr(H2O) =
; Мr(H2O) =  =18
=18
 =
= 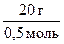 =
=  = 40 г/моль
= 40 г/моль
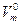 , равная 22, 4 л/моль, называется молярным объемом газа при нормальных условиях.
, равная 22, 4 л/моль, называется молярным объемом газа при нормальных условиях. при
при 
 и
и 
 :
:  , то
, то 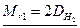 . Если плотность измерена по воздуху (Dвозд):
. Если плотность измерена по воздуху (Dвозд):  , то
, то  , где 29 — средняя молекулярная масса воздуха.
, где 29 — средняя молекулярная масса воздуха.






