Тема 8. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции. Все химически реакции подразделяются на два типа, протекающие с изменением или без изменения степени окисления атомов. Реакции, в результате которых изменяется степень окисления элементе! называют окислительно-восстановительными. Существует несколько способов составления уравнений окислительно-восстановительных реакций. Остановимся на методе электронного баланса, основанном на определении общего числа перемещающихся электронов. Например
Определяем, атомы, каких элементов изменили степень окисления, затем определяем число полученных электронов:
Число отдаваемых и присоединяемых электронов должно быть одинаковым:
Наименьшее общее кратное для данного примера равно 8. Основные коэффициенты при окислителе и восстановителе переносим в уравнение реакции
Процесс превращения серы из степени окисления -2 в +6 это процесс отдачи электронов, т. е. окисления; процесс превращения азота со степенью окисления +5 в +4 — процесс восстановления. Вещество MnS при этом является восстановителем, а HNO3 — окислителем. Рассмотрим более сложный пример. Взаимодействие сульфида мышьяка (III) с азотной кислотой выражается следующим уравнением:
Определяем окислитель и восстановитель в данной реакции. Индексы 2 и 3 при восстановителе вводим в электронное уравнение:
Наименьшее общее кратное будет равно 84. Вносим в уравнение реакции основные коэффициенты 3 и 28, а затем уравнение
3As2S3 + 28HNO3 = 6H3AsO4 + 9H2SO4 + 28NO
Число атомов водорода и кислорода уравниваем в последнюю очередь. В той части уравнения реакции, в которой их не хватает, добавляем воду. Окончательно уравнение принимает вид
3As2S3 + 28HNO3 + 4Н2О = 6H3AsO4 + 9H2SO4 + 28NO
|





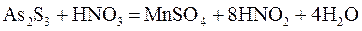


 — восстановитель,
— восстановитель,  — окислитель.
— окислитель.


