МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Реакция преципитации (РП), как и реакция агглютинации, принадлежит к разряду серологических реакций осадочного типа, но в отличие от РА в ней используют не корпускулярные, а растворимые антигены микроорганизмов. Образование комплексов антиген — антитело сопровождается изменением оптической плотности среды (помутнением) — преципитацией (от лат. praecipitatio — падение вниз), что расценивают как положительный результат реакции. Антиген для РП готовят из чистых культур микроорганизмов, если антиген предназначен для серодиагностики, или из тканевого материала, содержащего микроорганизмы, если РП ставят, чтобы при помощи известной иммунной сыворотки обнаружить возбудитель в патологическом материале. Физические методы экстрагирования антигенов основаны на механическом разрушении микробных клеток посредством растирания с кварцевым песком, встряхивания на шюттель-аппарате в колбе со стеклянными шариками, многократного замораживания и оттаивания или воздействия ультразвуком. Полисахаридные термостойкие антигены выделяют термической обработкой (кипячением, автоклавированием). Из химических методов получения антигенов достаточно широко используют экстрагирование трихлоруксусной кислотой (полный антиген Буавена); кислотный или щелочной термогидролиз—прогревание материала, например, в 1%-м растворе уксусной кислоты или 0, 1 н. растворе гидроксида натрия; экстрагирование при помощи ацетона, мочевины, этилового спирта, эфира и других растворителей; часто применяют различные детергенты — дезоксихолат натрия, лаурилсульфат натрия и т.д.; используют методы ферментативного разрушения микробных клеток, например, посредством воздействия трипсином. Выбор того или иного способа выделения растворимого антигена зависит от его химической природы. Главное требование к любому из методов — эффективное извлечение антигена без его денатурации. На основе феномена преципитации разработаны реакция кольцепреципитации (РКП), реакция диффузионной преципитации (РДП), радиальной иммунодиффузии; принцип реакциипреципитации использован в иммуноэлектрофорезе и встречном имщноэлектрофорезе. Реакция кольцепреципитации (РКП). Известна по имени автора как реакция Асколи (1911); разработана для диагностики сибирской язвы. РКП используют в ветеринарной диагностической практике преимущественно для выявления микробных антигенов в тканевом материале. Обязательное условие постановки РКП — прозрачность раствора антигена и иммунной сыворотки, поэтому при необходимости компоненты реакции освобождают от взвешенных частиц фильтрованием, например, через асбестовую вату. Техника постановки РКП включает в себя три варианта. Метод «наслаивания» антигена. В уленгутовские пробирки (диаметр 2...3 мм) вносят пастеровской пипеткой с тонким капилляром, не смачивая стенок пробирки, 0, 3...0, 4 мл иммунной преципитирующей сыворотки. Затем по стенке пробирки осторожно наслаивают на поверхность сыворотки 0, 1...0, 2 мл растворимого исследуемого антигена (преципитиногена). Смешивания компонентов не происходит благодаря различию плотности сыворотки и экстракта. Учет результатов проводят на фоне темной бумаги. Через 1...2мин в зоне взаимной диффузии антигена и антител, на границе контакта компонентов, происходит помутнение среды, видимое сбоку как серо-белый диск (преципитат). Метод «подслайвания» антител. В пробирку вначале вносят антиген, а затем осторожно при помощи пастеровской пипетки на дно пробирки, под антиген, «подслаивают» иммунную сыворотку. При постановке кольцевой РП в ходе исследования тканевого материала необходимы следующие контроли: 1) иммунная сыворотка + стандартный антиген; 2) иммунная сыворотка + физиологический раствор; 3) иммунная сыворотка + экстракт из тканей здоровых животных. Показания РП считают достоверными, если в первом контроле получают положительный, а в остальных — отрицательный результат (рис. 61).
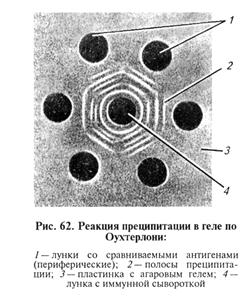
Микровариант РКП. Разработан для экономии компонентов. В этом случае используют стеклянные капилляры или тонко оттянутые кончики пастеровских пипеток диаметром 0, 5... 1 мм. Капилляр опускают одним концом во флакон с преципитирующей сывороткой, набирают ее на высоту 1...1, 5 см, закрывают верхнее отверстие капилляра указательным пальцем. Затем ватой удаляют излишек сыворотки с наружной стороны капилляра, погружают его в раствор антигена и набирают равное количество антигена. Капилляр переворачивают с таким расчетом, чтобы смесь сыворотки и антигена оказалась в середине капилляра, после чего закрепляют вертикально в пластилиновой пластинке. Результаты учитывают, как и при обычной РКП. Реакция диффузионной преципитации (РДП). Основана на встречной диффузии антител (иммунной сыворотки) и растворимых антигенов в агаровом геле (двойная диффузия). Если антиген состоит из смеси моноантигенов, то каждый из них диффундирует с различной скоростью и точки эквивалентных соотношений каждого антигена и гомологичных антител будут находиться в различных участках агарового геля, где и формируется преципитат в виде линий. Таким образом, каждая пара антиген — антитело образует свою линию преципитации. При помощи РДП можно анализировать сложные антигенные смеси, поскольку каждый антиген дает свою линию преципитации. В ряде случаев РДП используют как метод серологической диагностики инфекционных болезней. Из очищенного агара фирмы «Дифко» готовят 1, 5%-й раствор агара в физиологическом растворе (рН 7, 2...7, 4) с добавлением мертиолата (конечное разведение 1: 10 000) как консерванта. На хорошо обезжиренное стекло, лежащее строго горизонтально, наливают расплавленный агар в количестве, достаточном для формирования слоя геля толщиной 3...4 мм. Затем штампами вырезают лунки в агаровом геле; агар из лунки удаляют с помощью трубочек. На дно лунки вносят каплю горячего агара с последующим его удалением, что создает «дно» лунки и предотвращает подтекание компонентов под гель. В зависимости от конкретной задачи применяют штампы с различным количеством пробойников, обеспечивающие получение лунок разного диаметра и на разном расстоянии. При изучении неизвестных реагентов оптимальное расстояние между лунками необходимо установить в предварительных опытах. В зависимости от конкретной задачи в центральную лунку вносят иммунную сыворотку, в периферические — анализируемые нтигены или наоборот. Сыворотка и антиген не должны выходить за пределы лунки на поверхность агара. Затем пластины помещают в эксикатор. На дно эксикатора наливают небольшое количество воды с антисептиком. Пластины с компонентами выдерживают при комнатной температуре 10.., 72 ч (рис. 62).
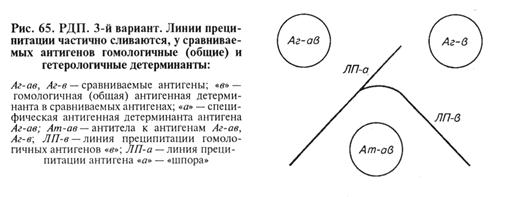
Учет результатов: полосы преципитации образуются только в зоне эквивалентности, т. е. там, где все антитела связаны с антигеном. (Если в жидкой среде соединить эквивалентные количества реагентов, то в надосадочной жидкости после формирования преципитата не будет свободных антигена и антител.) При изучении в РДП различных антигенов возможны три варианта результата реакции (рис. 63, 64, 65). 1. Реакция идентичности: слияние линий преципитации, относящихся к двум соседним антигенам (у сравниваемых антигенов гомологичные детерминанты — антигены оценивают как идентичные).
2. Реакция неидентичности: пересечение линий преципитации (у сравниваемых антигенов нет гомологичных антигенных детерминант). 3. Реакция неполной идентичности: неполное пересечение линий преципитации с формированием так называемой «шпоры». Такая картина возникает, когда у одного из антигенов помимо гомологичных есть и специфические детерминанты, которые второй антиген в составе своей молекулы не несет.
С помощью реакции диффузионной преципитации можно обнаруживать антитела в сыворотке крови и определять их титр. В этом случае в центральную лунку вносят известный растворимый антиген (бактериальный, вирусный), а в периферические — различные разведения исследуемой сыворотки крови (рис. 66).
Чтобы полосы преципитации стали более выраженными, пластины обрабатывают солями кадмия: пластины с готовым гелем отмывают в физиологическом растворе и заливают 0, 65%-м раствором сульфата кадмия. В результате через несколько минут полосы преципитации становятся более ярко выраженными (в несколько раз). Иммуноэлектрофорез (ИЭФ). Метод электрофоретического разделения антигенных смесей в агаровом геле с последующим выявлением отдельных антигенов при помощи реакции диффузионной преципитации. Иммуноэлектофорез применяют для изучения состава сложных антигенных смесей, например микробных растворимых антигенов, белков сыворотки крови и т.д. Для приготовления агарового геля и заполнения кювет электрофоретической камеры используют различные буферные растворы: 1) веронал-мединаловый (барбитуратный) буферный раствор, рН 8, 6, ионная сила 0, 05; веронал — 1, 84 г, мединал— 10, 3 г, дистиллированная вода —до 1000 мл; 2) трис-буфер, рН 8, 9; трис (оксиметил)-аминометан — 60, 5 г, этилендиаминотетра-уксусная кислота — 6 г, борная кислота — 4, 6 г, дистиллированная вода — до 1000 мл. Существует много других буферных растворов, различающихся по значениям рН и ионной силе. Ионная сила (р.) равна половине суммы произведения концентрации каждого иона, присутствующего в растворе, на квадрат его валентности. Чем ниже ионная сила буфера, тем быстрее двигаются белки, но чрезмерное снижение ионной силы ухудшает разделение компонентов. Для проведения электрофореза расплавленный гель наливают на стеклянные пластины размером (13...18) х (18...24) см (макрометод) или на предметные стекла (микрометод) слоем толщиной 2...4 мм. Затем в агаровом геле с помощью пробойников вырезают лунки для растворов, подлежащих электрофоретическому разделению. Если объем жидкости достаточно велик (макрометод), то ее предварительно диализируют против буферного раствора, который используют для электрофореза. Подготовленную пластину помещают в камеру для электрофореза (рис. 67, 68). Слой агара на пластине благодаря агаровым «мостикам» или полоскам хроматографической бумаги сообщается с анодной и катодной кюветами, заполненными буферным раствором. Ток через выпрямитель поступает на пластину с агаром (напряжение обычно 300...500 В и силой тока 30...40 А). Если градиент потенциала на агаровой пластине составляет 5...6 В/см, то на пластине длиной 18 см разгонка белков завершается за четыре-пять часов, при меньших размерах пластины разгонка происходит быстрее.
По истечении указанного времени пластину с гелем вынимают из камеры, в агаре по длине пластины прорезают траншею, которую заполняют иммунной сывороткой. Пластины помещают во влажную камеру. Образование дуг преципитации завершается через несколько сугок-(рис. 69). Электрофореграммы можно высушивать на стеклах, окрашивать или при помощи специальных реактивов определять химическую природу веществ в дугах преципитации.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Освоить технику постановки и учета результатов кольцевой 2. Изучить метод иммуноэлектрофореза, иммунофореграммы. Контрольные вопросы 1.В чем сущность феномена преципитации? 2.Какова техника постановки кольцевой РП и РДП? 3.Для каких целей применяют метод иммуноэлектрофореза?
Тема 17 РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА (РСК) Цель занятия. Ознакомить студентов с принципом и техникой постановки реакции связывания комплемента. Оборудование и материалы. Физиологический раствор, 2, 5%-я суспензия эритроцитов барана в физиологическом растворе, бруцеллезный антиген, положительная бруцеллезная сыворотка, нормальная сыворотка крупного рогатого скота, комплемент морской свинки, гемолизин, мерные пипетки на 1, 5 мл, водяная баня. МЕТОДИЧЕСКИЕ УКАЗАНИЯ Помимо серологических реакций осадочного типа (РА, РП) в диагностике инфекционных болезней широко используют реакцию связывания комплемента (РСК), в которой факт взаимодействия антигена и антитела устанавливают при помощи специальной индикаторной системы, которую лизирует комплемент. Механизм иммунного лизиса с участием комплемента рассмотрен в теме 15. РСК применяют как метод серологической диагностики и реже для обнаружения микробных антигенов в исследуемом материале. В РСК с одинаковым успехом можно использовать корпускулярные и растворимые антигены. Комплемент (С) не способен соединяться с антигеном (АГ) или с антителами (AT) в отдельности, но реагирует с образовавшимся комплексом АГ – AT. В РСК участвуют две системы: АГ – AТ и комплемент. Исследуемая АГ – АТ-система: искомый компонент (например, антитела) в ней может количественно варьировать или полностью отсутствовать. При взаимодействии комплемента с системой АГ - AT видимые феномены отсутствуют. Индикаторная АГ - АТ-система состоит из эритроцитов барана (антиген) и гемолизина (антитела к эритроцитам барана). При взаимодействии комплемента с системой АГ - AT наблюдают процесс иммунного лизиса эритроцитов. На конкуренции исследуемой и индикаторной систем АГ - AT за комплемент основана диагностическая РСК. Рассмотрим ее принцип на модели обнаружения антител в исследуемой сыворотке при помощи известного антигена. РСК ставят в два этапа. Сначала в пробирку вносят исследуемую сыворотку крови, известный антиген и комплемент. Смесь реагентов выдерживают в водяной бане при 37 °С 20...30 мин. Независимо от результата видимых изменений в пробирке не происходит (первая фаза РСК). Чтобы выяснить результат, в пробирку вносят индикаторную систему (вторая фаза РСК). После инкубирования всех компонентов учитывают результаты. Возможны два варианта результатов.
Антитела в исследуемой Комплекс АГ-АТ-С не образовался, С остался в сыворотке отсутствуют активном состоянии и способен реагировать с другим комплексом АГ-АТ, т.е. лизировать индикаторную систему
Антитела в исследуемой Образовался комплекс АГ-АТ-С, комплемент Сыворотке присутствуют инактивирован, при внесении в пробирку Индикаторной системы ее лизис не происходит
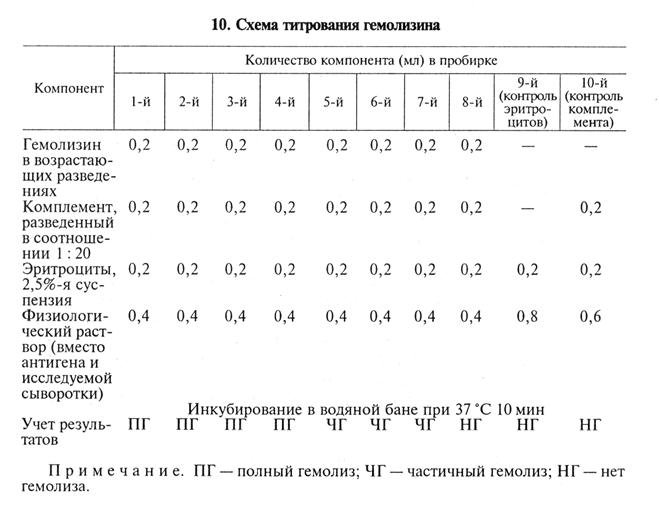
Компоненты РСК. При введении всех компонентов в строго определенном количественном соотношении реакция дает достоверные и воспроизводимые результаты. Солевой раствор для разведения компонентов: используют физиологический раствор. Более стабильные результаты иммунного гемолиза получают при введении в раствор ионов Са2+ и Mg2+, поскольку они необходимы для эффективного действия системы комплемента. Эритроциты барана: эритроциты дефибринированной крови барана отмывают физиологическим раствором (2500 мин-1 три раза по 5 мин). В реакции обычно используют 2, 5%-ю суспензию. При необходимости длительного использования ее хранят в растворе Ольсвера: хлорид натрия — 4, 2 г, лимонная кислота — 0, 55 г, цитрат натрия — 8 г, декстроза — 20, 5 г, дистиллированная вода—10мл (рН 6, 1). Раствор стерилизуют автоклавированием и смешивают с кровью в соотношении 1: 2. Эритроциты, хранящиеся в растворе Ольсвера при 4...6°С, можно использовать в течение З0...40сут. Гемолизин выпускают биофабрики. Представляет собой сыворотку крови кролика, иммунизированного эритроцитами барана, содержащую антитела к эритроцитам. На коробках с гемолизином указывают его активность в виде титра, определенного в реакции иммунного лизиса. Комплемент — сыворотка крови морской свинки. Биофабрики выпускают комплемент в лиофилизированном виде (срок годности 1 год). В случае необходимости комплемент можно получить пункцией сердца морской свинки при помощи шприца с иглой. Антиген: диагностические антигены для РСК готовят на биофабриках. На коробках с антигеном указывают его активность (титр антигена) в виде разведения, рекомендованного для использования в РСК. Титрование гемолизина. При достаточно длительном хранении необходимо определять активность гемолизина путем его титрования в реакции иммунного гемолиза. Результаты этого опыта показывают, в какой оптимальной концентрации необходимо вводить в РСК гемолизин, чтобы обеспечить работу индикаторной системы. Титром гемолизина называют его максимальное разведение, при котором в присутствии оптимального количества комплемента гемолизин способен обеспечить полный лизис суспензии эритроцитов. При титровании готовят вспомогательные разведения гемолизина (табл. 9). Их переносят в 8 пустых пробирок и добавляют другие компоненты (табл. 10).
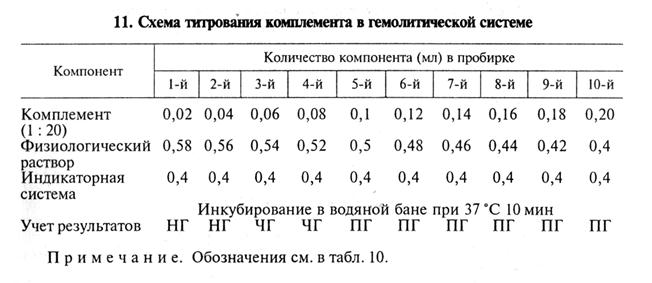
В приведенном примере титр гемолизина составляет 1: 2000 (4-я пробирка). Для постановки РСК обычно берут удвоенное количество гемолизина — в данном случае 1: 1000 (рабочий титр). Титрование комплемента. Комплемент титруют каждый раз в день постановки главного опыта РСК. За титр комплемента принимают его минимальное количество, которое вызывает полный лизис определенной дозы суспензии эритроцитов в присутствии рабочей дозы гемолизина. Комплемент титруют в гемолитической или бактериолитической системе. Титрование комплемента в гемолитической системе, например, может быть проведено по указанной схеме (табл. 11).
В нашем примере титр комплемента составил 0, 1 мл. Активность комплемента могут снижать антиген и исследуемая сыворотка (антикомплементарное действие). Чтобы нивелировать ан-тикомплементарность компонентов, комплемент берут в опыт на 20...40 % больше установленного титра. Для более точного определения титра рекомендуют титровать комплемент в присутствии сыворотки крови и антигена (титрование в бактериолитической системе). Например, при серодиагностике бруцеллеза комплемент титруют на негативной и позитивной сыворотках, полученных от животных того же вида, что и исследуемая сыворотка. Каждую сыворотку разводят физиологическим раствором в соотношении 1: 5 и прогревают в водяной бане для инактивации собственного комплемента: сыворотки крупного рогатого скота — при 60...62 º С, лошадей —при 56...58 °С, буйволов —при 62...64°С, ослов и мулов —при 64...65 º С, овец и коз —при 58...60°С 30 мин, свиней —при 60...62°С 50 мин. Схема титрования комплемента в бактериолитической системе показана в таблице 12.
Титром комплемента считают минимальное его количество, которое обеспечивает полный гемолиз суспензии эритроцитов в пробирках с негативной сывороткой и антигеном и позитивной сывороткой без антигена. В данном примере титр комплемента равен 0, 1 мл (5-я пробирка). В качестве рабочего титра берут количество комплемента на 0, 02 мл больше, т. е. 0, 12 мл. Главный опыт РСК. Кроме исследуемых сывороток крови при постановке основного опыта РСК в качестве контрольных используют положительную и отрицательную сыворотки крови. Все сыворотки предварительно разводят физиологическим раствором в соотношении 1: 5 и прогревают при 56...64 º С в водяной бане для инактивации собственного комплемента. Схема главного опыта показана в таблице 13.
Результат РСК учитывают по наличию или отсутствию гемолиза эритроцитов в пробирках и выражают в крестах: 1)(++++) — полная задержка гемолиза (после оседания эритроцитов жидкость прозрачная); 2) (+++) — задержка гемолиза сильно выражена (после оседания эритроцитов жидкость слаборозового цвета); 3) (++) — частичная задержка гемолиза (после оседания эритроцитов жидкость интенсивно окрашена в красный цвет); 4) (+) — слабая задержка гемолиза (незначительный осадок эритроцитов, жидкость интенсивно окрашена); 5) (—) — полный гемолиз, осадка эритроцитов нет. Как положительный результат РСК оценивают задержку гемолиза минимум на два креста и более. Учет результатов начинают с контрольных пробирок: 7-я пробирка — контроль физиологического раствора: гемолиза не должно быть; 6-я пробирка — контроль индикаторной системы и комплемента: должен быть полный гемолиз; 5-я пробирка — контроль антигена: должен быть полный гемолиз; 3-я пробирка — контроль с отрицательной сывороткой: должен быть полный гемолиз; 2-я пробирка — контроль с положительной сывороткой: должна быть задержка гемолиза. Если все перечисленные контроли свидетельствуют о правильности приготовления компонентов реакции и выборе их доз, приступают к учету результатов РСК с исследуемой сывороткой крови. Первоначально учитывают результаты в 4-й пробирке (безантигенный ряд) — контроль антикомплементарности сыворотки. При полном гемолизе в 4-й пробирке (отсутствие антикомплементарности) можно учитывать результат в 1-й пробирке (антигенный ряд), где результат может варьировать от полного гемолиза (отрицательный результат) до полной задержки гемолиза (положительный результат). Если исследуемая сыворотка антикомплементарна, то результат в первой пробирке учитывать нельзя и от этого животного необходимо брать кровь для повторного исследования. Окончательный учет результатов РСК проводят через 18...20 ч, за это время нелизированные эритроциты оседают на дно пробирки. В приведенном примере рассмотрен вариант постановки РСК в объеме 1 мл, когда каждый компонент взят в объеме 0, 2 мл. Возможна постановка РСК в макроварианте (2, 5 мл) или в капельном варианте. Расчет количества компонентов для постановки РСК. Например, необходимо исследовать 100 сывороток крови. Сыворотку крови исследуют в разведениях 1: 5, кроме того, с тем же разведением ставят контроль на антикомплементарные свойства сыворотки (безантигенный ряд). Следовательно, на каждую сыворотку необходимо 2 пробирки, на 100 сывороток — 200 пробирок. РСК ставим в объеме 1 мл, и каждый компонент необходимо приготовить в объеме 40 мл (0, 2*200): гемолизин в рабочем титре, антиген в рабочем титре, 2, 5%-я суспензия эритроцитов барана. Титр комплемента в нашем опыте составил 0, 12 мл в разведении 1: 20. Следовательно, на 200 пробирок необходимо 24 мл комплемента, разведенного 1: 20 (0, 12*200 = 24), а неразведенного — 1, 2 мл (24: 20 = 1, 2). Ампула (флакон) обычно содержат 2 мл комплемента, и для проведения этого опыта достаточно вскрыть одну ампулу, взять из нее 1, 2 мл комплемента и добавить к 38, 8 мл физиологического раствора. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Провести титрование гемолизина и комплемента и определить их рабочие титры. 2. Поставить главный опыт РСК и учесть результаты. Контрольные вопросы 1. Что представляет собой комплемент морской свинки? Как его консервиру- 2.На чем основано получение гемолизина? 3.В чем сущность иммунного гемолиза? 4.Что такое титр и рабочий титр гемолизина и комплемента? 5.Какова схема главного опыта РСК? 6.Для чего используют РСК?
|