Соли кислородсодержащих кислот. СульфатSc2(SO4)3∙nH2O может быть получен упариванием растворов оксида, гидроксида или карбоната скандия в разбавленной H2SO4
Сульфат Sc2(SO4)3∙ nH2O может быть получен упариванием растворов оксида, гидроксида или карбоната скандия в разбавленной H2SO4. Гидраты сульфата скандия могут содержать 2, 3, 5 и 6 молекул воды. При нагревании кристаллогидрат Sc2(SO4)3∙ 6H2O обезвоживается и разлагается: Sc2(SO4)3∙ 6H2O Безводный сульфат скандия – белое гигроскопичное кристаллическое вещество, хорошо растворимое в воде. Может быть получен действием концентрированной серной кислоты на оксид или гидроксид скандия и обезвоживанием кристаллогидрата сульфата при 250˚ С. Из водных сернокислых растворов выделяются сульфаты скандия: основный ScOHSO4·2H2O и средний Sc2(SO4)3∙ 5H2O. В концентрированных растворах H2SO4 (> 42 %), средний сульфат обезвоживается, и далее образуется сольват Sc2(SO4)3∙ 3H2SO4. В системах с сульфатами щелочных металлов и аммония выделяются комплексные соединения Me[Sc(SO4)2] и Me3[Sc(SO4)3]. С сульфатами Li и Na образуются комплексы только первого типа – Me[Sc(SO4)2]∙ nH2O. С сульфатами K, Rb, Cs и NH4+ образуются оба типа комплексных соединений. Комплекс Me3[Sc(SO4)3] в воде превращается в Me[Sc(SO4)2]. Термическая устойчивость комплексных сульфатов скандия понижается с увеличением радиуса Me+. Двойные сульфаты скандия и аммония или натрия хорошо растворяются в воде и концентрированных растворах (NH4)2SO4 и Na2SO4. K3[Sc(SO4)3] практически нерастворим в K2SO4, поэтому его предложено использовать для отделения скандия от элементов иттриевой подгруппы. K3[Y(SO4)3] растворяется в 30 раз лучше, чем K3[Sc(SO4)3]. Основный тиосульфат Sc(OH)S2O3 образуется при действии тиосульфата натрия на растворы хлорида или нитрата скандия: ScCl3 + Na2S2O3 + H2O = Sc(OH)S2O3 + 2NaCl + HCl. Sc(OH)S2O3 представляет собой желтоватый кристаллический хорошо фильтрующийся осадок. Используется для отделения скандия от лантаноидов. При осаждении тиосульфата скандия в кислой среде (рН = 2) лантаноиды остаются в растворе. Нитрат Sc(NO3)3·4H2O получается в виде кристаллогидрата растворением оксида, гидроксида или карбоната скандия в разбавленной HNO3 с последующим упариванием растворов. Это кристаллическая гигроскопичная соль, хорошо растворимая в воде, спирте, эфире и др. органических растворителях. В зависимости от концентрации HNO3 из водных растворов выделяются ScOH(NO3)2∙ 3H2O, Sc(NO3)3·4H2O, Sc(NO3)3·3H2O, Sc(NO3)3·2H2O, Sc(NO3)3·2HNO3. По составу, строению и свойствам нитраты скандия сходны с нитратами индия и тяжелых редкоземельных элементов, но имеют и существенное различие. Например, основный и средний нитраты хорошо растворимы в воде, их растворимость с повышением температуры возрастает (табл. 2.1).
Таблица 2.1. Растворимость нитратов скандия при различных температурах
Нитраты скандия отличаются высокой термической устойчивостью: Sc (NO3)3 Нитраты скандия можно использовать для его экстрагирования органическими растворителями. Карбонат скандия. Для скандия характерно образование основных карбонатов переменного состава: Sc(OH)CO3·H2O, [Sc(OH)m]2(CO3)3-m·3H2O. Они нестойки, легко разлагаются при нагревании. Образуются в виде объемистого белого осадка при действии карбонатов аммония или щелочных металлов на растворы солей скандия. Растворяются в растворах (NH4)2CO3 и Na2CO3, образуя комплексные соединения Ме[Sc(CO3)2]∙ nH2O, Ме5[Sc(CO3)4]∙ nH2O, мало растворимы в воде и слабокислых растворах; могут быть использованы для отделения скандия от других элементов. Устойчивость однотипных комплексных карбонатов скандия увеличивается в ряду NH4 < Na < K < Rb < Cs. В воде карбонатные комплексы гидролизуются, степень гидролиза понижается в той же последовательности. Растворяются в кислотах и концентрированных растворах карбонатов аммония и натрия. Осаждение двойного карбоната натрия используется для отделения скандия от тория, который остается в виде растворимого комплекса в растворе. Фосфаты скандия. Ортофосфат ScPO4∙ 2H2O образуется действием на водные растворы солей скандия фосфорной кислоты. Аналогичен фосфатам иттрия, РЗЭ, Ga, In и других металлов. В отличие от фосфатов РЗЭ фосфат скандия выделяется из раствора только в виде дигидрата – устойчивого кристаллического соединения, существующего в природных условиях. Обладает низкой растворимостью. Для скандия характерно образование дигидрофосфата Sc(H2PO4)3, неустойчивого при нагревании Sc(H2PO4)3 Пирофосфат Sc4(P2O7)3 образуется действием пирофосфата натрия на растворы солей скандия: 4ScCl3 + 3Na4P2O7 = Sc4(P2O7)3 + 12NaCl. Он отличается от аналогичных соединений других элементов своей малой растворимостью даже в минеральных кислотах, что может быть использовано для отделения Sc от сопутствующих элементов. Пирофосфат натрия осаждает из растворов солей скандия трудно растворимый осадок NaScP2O7∙ 3H2O, который можно рассматривать как натриевую соль скандий-пирофосфорной кислоты. Аналогичные соединения известны для РЗЭ. Хроматы скандия. Средний хромат Sc2(CrO4)3 получен действием хромовой кислоты на растворы солей скандия. Кристаллизуется с различным числом молекул воды – Sc2(CrO4)3·nH2O, где n = 1, 3, 6. Получен основный хромат ScOHCrO4·H2O. Хроматы скандия способны, подобно хроматам РЗЭ, образовывать двойные соединения состава Me[Sc(CrO4)2]·nH2O, где Me – NH4+, Na, K, Rb, Cs. Молибдаты скандия. Средний молибдат Sc2(MoO4)3 получают путем сливания растворов ScCl3 и (NH4)2MoO4 в диапазоне рН = 2, 5-6 или спекания оксидов Sc2O3 и MoO3. Это белое безводное, термически устойчивое, кристаллическое вещество. До 1300˚ С не претерпевает никаких превращений. Плавится при 1900±50˚ С без разложения. Плотность сухой соли 2, 93 г/см3, прокаленной – 3, 09 г/см3. Образует двойные молибдаты Me[Sc(MoO4)2], где Me – Li, Na, K, температуры плавления которых 820, 940, 1100˚ С соответственно. Вольфраматы скандия. Вольфрамат Sc2(WO4)3·10H2O получают подобно молибдату, сливая вместе растворы ScCl3 и (NH4)2WO4 в диапазоне рН = 3, 5–5. Это белое рентгеноаморфное вещество. В интервале температур 50-300˚ С обезвоживается. Вода удаляется в две стадии. При 50-150˚ С удаляются 7H2O, при 300˚ С – остальные 3H2O. Плавится при 1620±50˚ С без разложения. Плотность – 3, 48 г/см3. Безводная соль получается спеканием оксидов Sc2O3 и WO3 при 1000˚ С. Образует двойные вольфраматы Me[ Sc(WO4)2], где Me – Li, Na, K, температуры плавления которых 990, 860, 1170˚ С соответственно. Свойства сульфата, хромата, молибдата, вольфрамата и соответствующих основных солей скандия изменяются в зависимости от природы анионов. Так, растворимость в воде и склонность к гидролизу соединений скандия уменьшается по ряду CrO42ˉ > SO42ˉ > MoO42ˉ > WO42ˉ. Термическая устойчивость этих соединений увеличивается в обратной последовательности. В этой же последовательности увеличивается и прочность связи Sc3+ – анион. Свойства двойных солей – Me[Sc(ЭO4)2] (где Me – Li, Na, K, Rb, Cs; Э – S, Cr, Mo, W) изменяются в зависимости от природы не только аниона, но и однозарядного катиона. Устойчивость этих соединений увеличивается в рядах от Li к Cs и WO42- ≈ MoO42ˉ < SO42ˉ < CrO42ˉ.
|

 Sc2(SO4)3∙ 2H2O
Sc2(SO4)3∙ 2H2O 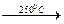 Sc2(SO4)3
Sc2(SO4)3 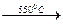 Sc2O(SO4)2
Sc2O(SO4)2  Sc2O3.
Sc2O3.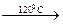 Sc2O (NO3)4
Sc2O (NO3)4  ScONO3
ScONO3 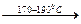 Sc4O5 (NO3)2
Sc4O5 (NO3)2 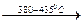 Sc 2O3.
Sc 2O3.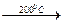 [Sc(PO3)3]n
[Sc(PO3)3]n 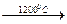 ScPO4.
ScPO4.


