Дозиметрия.
Интенсивность радиоактивного излучения количественно характеризуется числом распадов за 1 с (активностью): A = N/t Активность в СИ измеряется в бекерелях (Бк). Часто используют внесистемную единицу Кюри (Ки), 1 Ки = 3.7 1010 Бк. Количественно оценить воздействие излучения на живые организмы затруднительно, т.к. эффективность его действия зависит от многих факторов: природы ионизирующих частиц, вида ткани, вида (сложности) самого организма, состояния его здоровья. Дозой облучения (экспозиционной дозой) называется энергия, попадающая на вещество за определенное время. Размерность Д0 - Кл/кг. 1 Кл/кг означает, что суммарный заряд ионов одного вида, производимых в 1 кг облученного воздуха, равен 1 Кл. Оценить дозу, поглощенную тканью, очень сложно. Для оценки биологического воздействия облучения используется соотношение: Биологическая доза Дб = Д0 ОБЭ, где ОБЭ – относительная биологическая эффективность, определяемая из опыта. Примерные значения ОБЭ: · 1 – b- и g–излучения, · 5 – медленные нейтроны, · 10 – быстрые нейтроны, · 10 – протоны, · 20 – a-частицы. Если одновременно имеются различные виды излучения, то результирующий эффект определяется суммой биологических доз. Предельно допустимая доза составляет 1,3 мКл/кг в год. Естественный фон (порожденный космическими лучами, радиоактивностью окружающей среды и самого человека) примерно равен 25 мкКл/кг в год. При больших дозах:
Способы защиты от радиации зависят от ее вида: · a-частицы - имеют малую длину пробега, поэтому их задерживает даже тонкий слой вещества (например, воздуха). Опасность представляет попадание a-частиц внутрь (с воздухом и пищей), а также тормозное рентгеновское излучение. · b-излучение – разносится ветром и водой, попадает в продукты питания. Например, 9038Sr (Т1/2 = 28 лет) накапливается в костной ткани, облучая костный мозг. Защитой могут служить многослойные толстые экраны из специальных веществ. · g-излучение и нейтроны – особо опасная проникающая радиация. Нейтроны вызывают наведенную a,b,g–активность в веществе. Защитой могут служить толстые экраны из свинца, железа, бетона.
Лекция 13. Динамические и статистические закономерности.
Перейдем к рассмотрению систем, состоящих из большого числа микрочастиц. Эти частицы взаимодействуют друг с другом и с телами, внешними по отношению к системе, но исследователя не интересует поведение каждой отдельной частицы, а лишь то, как результат этих взаимодействий отразится на поведении системы в целом. Процессы, происходящие в макроскопических телах, но обусловленные их внутренним строением из микрочастиц, изучают молекулярная физика и термодинамика. Таким образом, круг явлений, изучаемых этими науками, один и тот же. Различие состоит в методах, которые используются · 1-й метод базируется на представлении о макросистеме как о совокупности огромного числа частиц и изучает закономерности их коллективного поведения. При этом учитывается, что координаты и импульс каждого элемента случайны в любой момент времени, поведение отдельной частицы может быть описано лишь с некоторой вероятностью, поэтому используется аппарат теории вероятностей и математической статистики. Этот статистический подход позволяет выяснить механизм явлений, происходящих в сложных системах, но и сам является достаточно сложным. · 2-й метод не опирается на представление о внутреннем строении изучаемых систем и не касается вопроса о механизме явлений. Этот метод устанавливает количественные законы превращения энергии в различных процессах и называется термодинамическим. Термодинамика имеет дело с непосредственно измеряемыми величинами: давлением, объемом, температурой, концентрацией - и устанавливает связи между ними. Термодинамика отличается простотой, ее основные положения являются обобщением опытных фактов. Статистическая физика и термодинамика взаимосвязаны и взаимно дополняют друг друга.
Состояние любой системы может быть задано с помощью ряда параметров. Например, для газа это давление, объем и температура: (р,V,Т). Состояние, при котором во всех точках системы все параметры имеют одно и то же значение и остаются постоянными при неизменных внешних условиях, называется равновесным. Система может находиться в равновесном состоянии сколь угодно долго. В неравновесном состоянии параметры либо не постоянны, либо вообще не определены. Пусть внешние условия слегка изменились. Опыт говорит о том, что система постепенно перейдет в новое состояние равновесия. Это утверждение настолько важно, что носит название 0-го начала термодинамики: Для каждой термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях достигает. Фактически 0-е начало постулирует существование такого параметра, как температура. Если внешние условия изменяются достаточно медленно, то система успевает достигнуть состояния равновесия. Процесс, протекающий в термодинамической системе, будет представлять из себя ряд последовательных равновесных состояний. Такой медленный процесс называется равновесным (квазистатическим). Напротив, быстропротекающие процессы являются неравновесными. Система может вернуться обратно в исходное состояние через те же равновесные состояния, т.е. равновесный процесс обратим. Неравновесный процесс необратим. Очевидно, что равновесный обратимый процесс – идеализированная модель, а все реальные процессы неравновесны и необратимы. Термодинамика равновесных процессов хорошо разработана. В настоящее время активно изучаются именно неравновесные, нелинейные процессы, что приводит к наиболее интересным результатам.
Температура впервые осознается человеком как степень нагретости тела. Но такие ощущения субъективны и не могут быть взяты за количественные характеристики состояния тел (систем). Объективные критерии появились лишь с созданием теплоизмерительных приборов – термометров, в которых используются такие явления, как расширение тел при нагревании, изменение их электрических свойств и т.п. Приведем сравнение самых употребительных температурных шкал:
Долгое время естествоиспытатели не разделяли температуру и теплоту, которую, в свою очередь, считали либо веществом, либо состоянием. В 1755 г. М.В.Ломоносов впервые указал, что температура – степень теплоты – определяется скоростью движения частиц, а количество теплоты зависит от общего количества движения этих частиц, т.е. от кинетической энергии. В настоящее время общеизвестно, что
т.е. термодинамическая температура с точностью до постоянного множителя ( Итак, в равновесных системах Т>0. При Т®+0 тепловое движение полностью прекращается, энергия системы минимальна. До сих пор речь шла о равновесных состояниях идеального газа – физической модели, предполагающей, что молекулы представляют собой материальные точки, взаимодействующие только при соударениях. Для реальной - неравновесной системы, обладающей конечным максимальным значением энергии (с конечным числом энергетических уровней) удается ввести понятие отрицательной абсолютной температуры. Если подводить к такой системе энергию, можно добиться максимальной неравновесности, т.е. ситуации, когда все частицы окажутся в возбужденном состоянии. Это положение неустойчивого равновесия характеризуется температурой Т®-0. Такое состояние называется метастабильным, и оно осуществляется, например, в лазере. Поддерживать систему в метастабильном состоянии можно, только подводя к ней энергию; предоставленная самой себе, она выйдет из этого состояния.
Кинетическая энергия движения молекул и потенциальная энергия их взаимодействия составляют внутреннюю энергию системы. Изменить энергию термодинамической системы можно двумя способами: · Путем теплопередачи – при непосредственном контакте или на расстоянии, радиационными методами (с помощью излучения). Таким образом, система получает или отдает некоторое количество теплоты Q. · Путем совершения работы. Работу газа в термодинамике легко вычислить: при малом изменении объема
Получить полезную работу от термодинамической системы – главная практическая цель термодинамических исследований. Выражение для А показывает, что при V = const работа не производится. Наглядно изобразить работу термодинамической системы можно, если графически представить процесс на осях (p,V) – это площадь фигуры под графиком процесса.
Лекция 14. Энергия в термодинамических процессах.
|

 ,
, ) равна средней кинетической энергии поступательного движения молекулы.
) равна средней кинетической энергии поступательного движения молекулы. она равна
она равна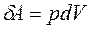 .
.


