Определение молярной массы эквивалента металла.
Цель работы – освоить объемный метод определения молярной массы эквивалента исследуемого металла (метод вытеснения водорода). Задание по работе. На основании уравнений Менделеева – Клапейрона и объединенного газового закона вычислите массу и объем (н.у.) выделившегося водорода. Определите молярную массу эквивалента водорода и металла, эквивалентный объем водорода, абсолютную и относительную погрешности и сделайте выводы по проделанной работе. Методические указания по выполнению работы. В основу метода положена реакция взаимодействия металла с раствором хлороводородной (соляной) кислоты, продуктом которой является газообразный водород 2HCl + Ме → МеCl2 + H2↑. Определение эквивалентной массы металла (молярной массы эквивалента металла) по объему вытесненного водорода проводят, применяя математическое выражение закона эквивалентов m(в-ва)/ m(Н2) = МЭКВ.(в-ва)/МЭКВ.(Н2) или m(в-ва)/МЭКВ.(в-ва) = V(Н2)/VЭКВ.(Н2). Получение и измерение объема выделившегося водорода осуществляется в лабораторной установке (рис.1). Установка состоит из двух бюреток: рабочей измерительной Б1 и уравнительной Б2, соединенных резиновой трубкой Т и заполненных дистиллированной водой. К рабочей бюретке при помощи газоотводной трубки Г присоединена пробирка П. Перед началом выполнения опыта необходимо проверить герметичность установки. Для этого пробирку плотно наденьте на пробку газоотводной трубки, после чего уравнительную бюретку поднимите или опустите на 15-20 см, закрепите ее в этом положении лапками штатива и наблюдайте в течение 1-2 минут за положением в ней уровня жидкости. Если за это время уровень воды не изменится, это будет означать, что прибор герметичен и можно, приступать к выполнению работы. В пробирку П налейте 1.5 – 2,0 мл 20%-ного раствора соляной кислоты, опустите в пробирку навеску металла наденьте пробирку на пробку с газоотводной трубкой, не нарушая герметичности прибора запишите начальный объем (VНАЧ.). Затем постукивая пальцем по пробирке, стряхните металл в раствор кислоты. Когда весь металл растворится и прекратится выделение пузырьков водорода, дайте пробирке в течение 1-2 минуты остыть, и, не отсоединяя пробирку, приведите положение жидкости в измерительной и уравнительной бюретке по нижнему краю мениска к одному уровню, для чего уравнительную бюретку опустите вниз. Запишите показания бюретки VКОН. По разности определите объем выделившегося водорода в мл.
Рис.1. Лабораторная установка для определения эквивалентной массы металла.
Запись экспериментальных данных и условий опыта: Масса металла mМе, (г) = Начальный объем, (мл) tНАЧ.= Конечный объем, (мл) tКОН,= Объём выделившегося водорода, (мл) VH2 = VКОН.–VНАЧ.= Температура (° С) t = Абсолютная температура (К) Т = 273 + t0С = Атмосферное давление (мм рт. ст.) Р = Давление насыщенного водяного пара (табл.1), (мм рт.ст.) h, = Парциальное давление водорода, (мм.рт.ст.) РН2 = Р – h = Универсальная газовая постоянная, (мл.·мм.рт.ст./ моль· К) = 62400 ВЫЧИСЛЕНИЯ Рассчитайте молярную массу эквивалента металла двумя способами: 1. Подставив в уравнение Менделеева – Клапейрона
соответствующие величины вычисляем массу выделившегося водорода
Затем, по закону эквивалентов, вычислите молярную массу эквивалента металла: Мэме= 2. По уравнению объединенного газового закона:
приводим объём выделившегося водорода к нормальным условиям (определяем V0Н2). V0= Вычисляем молярную массу эквивалента металла, заменив массу и молярную массу эквивалента водорода в уравнении закона эквивалентов на соответствующие им объёмные значения: МэМе = mМе·11200/ V0(H2) 3. Вычислите абсолютную ошибку опыта. Для этого рассчитайте теоретическую молярную массу эквивалента металла, взяв атомную массу металла (из таблицы Д.И. Менделеева), и разделите её на валентность. Абсолютная ошибка ∆ = МЭКВ.ТЕОР.- МЭКВ.ЭКСПЕР.[г/моль]. 4. Вычислите относительную ошибку опыта в процентах: Относительная ошибка ∆% = (∆ / МэТЕОР) · 100.
|


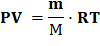
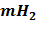 (Подставив R = 62400 мм рт. ст./ моль ·К)
(Подставив R = 62400 мм рт. ст./ моль ·К)

 =
= 




