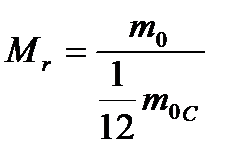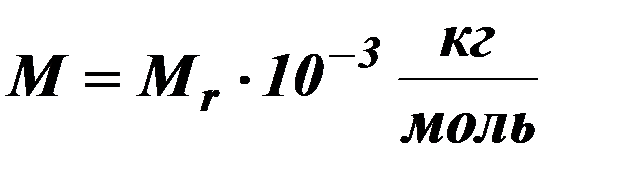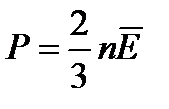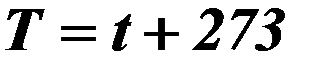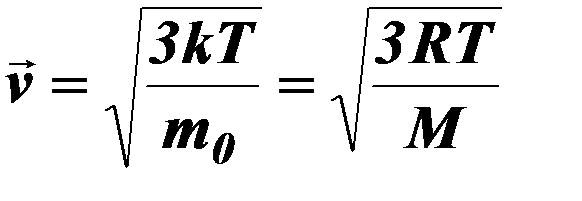1.1.  1.2.
1.2. 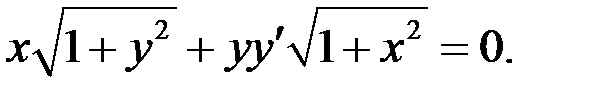
1.3.  1.4.
1.4. 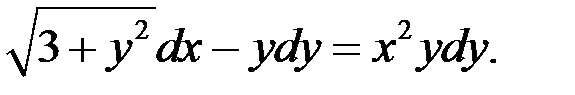
1.5. 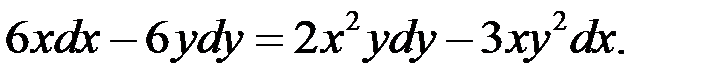 1.6.
1.6. 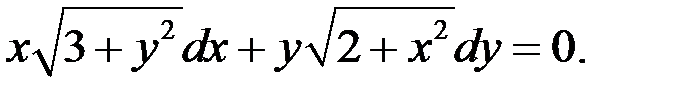
1.7.  1.8.
1.8. 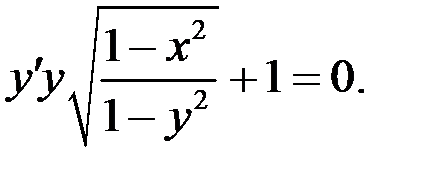
1.9.  1.10.
1.10. 
1.11.  1.12.
1.12. 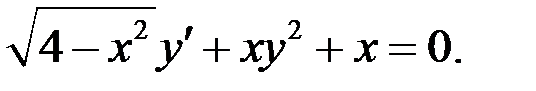
1.13.  1.14.
1.14. 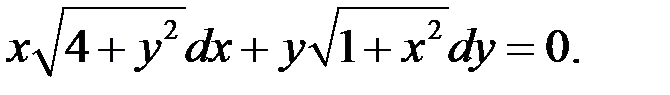
1.15.  1.16.
1.16. 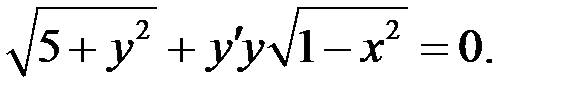
1.17. 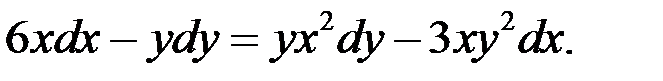 1.18.
1.18. 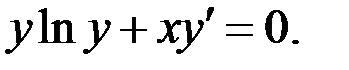
1.19.  1.20.
1.20. 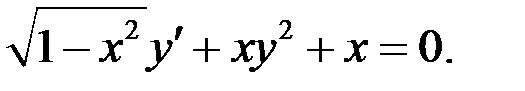
1.21.  1.22.
1.22. 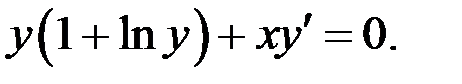
1.23.  1.24.
1.24. 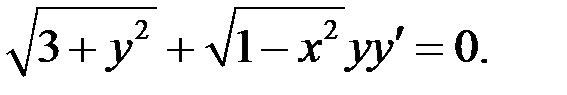
1.25.  1.26.
1.26. 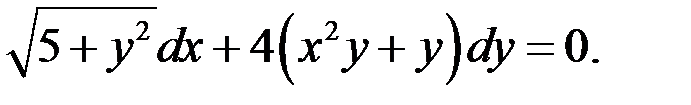
1.27.  1.28.
1.28. 
1.29.  1.30.
1.30. 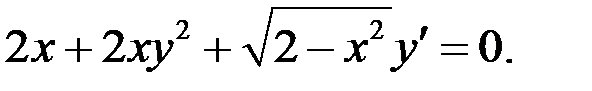
2.1.  2.2.
2.2.  2.3.
2.3. 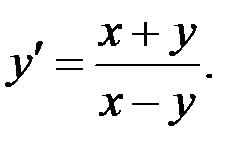
2.4.  2.5.
2.5.  2.6.
2.6. 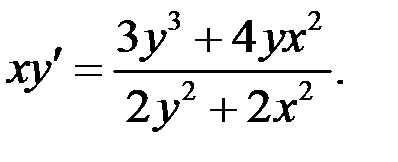
2.7.  2.8.
2.8.  2.9.
2.9. 
2.10.  2.11.
2.11.  2.12.
2.12. 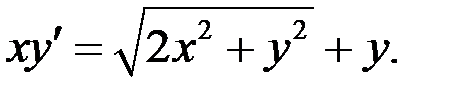
2.13.  2.14.
2.14. 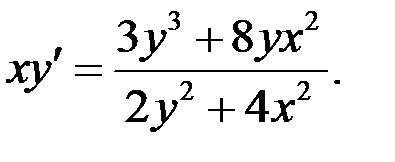 2.15.
2.15. 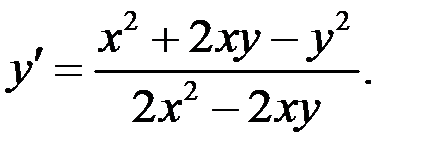
2.16.  2.17.
2.17.  2.18.
2.18. 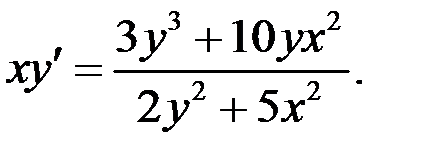
2.19.  2.20.
2.20.  2.21.
2.21. 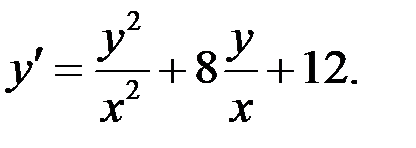
2.22.  2.23.
2.23.  2.24.
2.24. 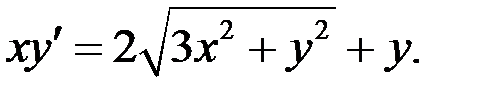
2.25.  2.26.
2.26.  2.27.
2.27. 
2.28.  2.29.
2.29.  2.30.
2.30. 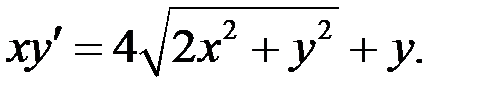
2.1.  . 2.2.
. 2.2.  . 2.3.
. 2.3. 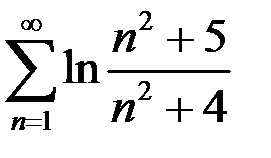 .
.
2.4. 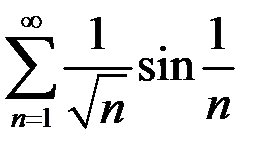 . 2.5.
. 2.5.  . 2.6.
. 2.6.  .
.
2.7.  . 2.8.
. 2.8.  . 2.9.
. 2.9. 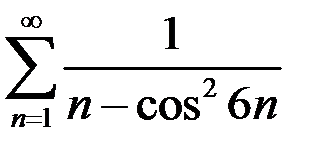
.2.10. 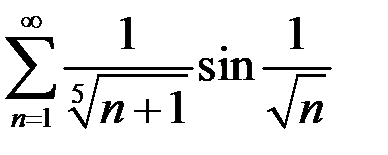 . 2.11.
. 2.11.  . 2.12.
. 2.12. 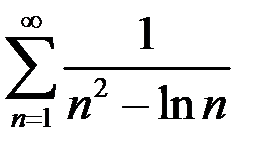 .
.
2.13. 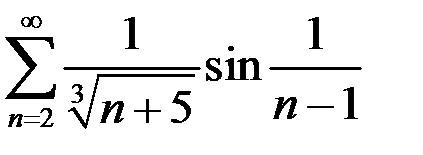 . 2.14
. 2.14 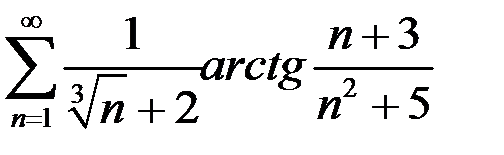 . 2.15.
. 2.15.  .
.
2.16.  .2.17.
.2.17.  . 2.18.
. 2.18.  .
.
2.19.  . 2.20.
. 2.20.  .2.21.
.2.21.  .
.
2.22.  . 2.23.
. 2.23.  . 2.24.
. 2.24.  .
.
2.25.  . 2.26.
. 2.26.  . 2.27.
. 2.27.  .
.
2.28.  . 2.29.
. 2.29. 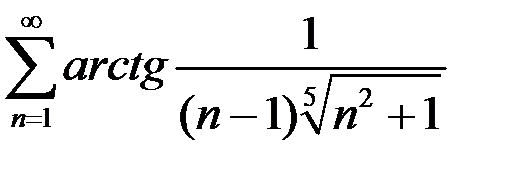 . 2.30.
. 2.30.  .
.
3.1.  . 3.2.
. 3.2. 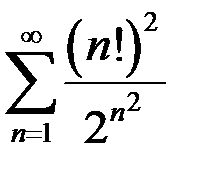 . 3.3.
. 3.3.  .
.
3.4.  . 3.5.
. 3.5.  . 3.6.
. 3.6.  .
.
3.7.  . 3.8.
. 3.8.  . 3.9.
. 3.9. 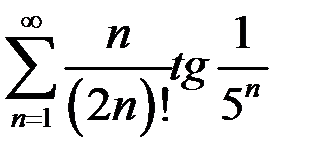 .
.
3.10. 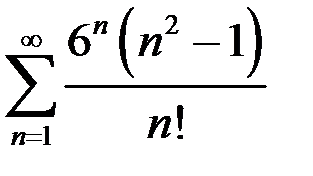 . 3.11.
. 3.11.  . 3.12.
. 3.12.  .
.
3.13.  . 3.14.
. 3.14.  . 3.15.
. 3.15.  .
.
3.16.  . 3.17.
. 3.17.  . 3.18.
. 3.18.  .
.
3.19. 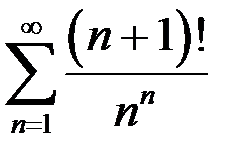 . 3.20.
. 3.20. 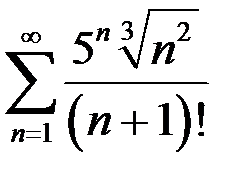 . 3.21.
. 3.21. 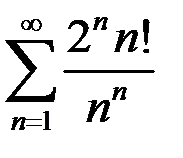 .
.
3.22. 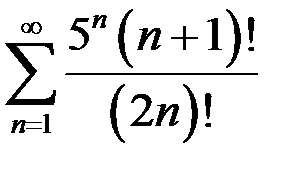 . 3.23.
. 3.23. 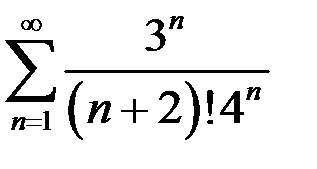 . 3.24.
. 3.24.  .
.
3.25.  . 3.26.
. 3.26. 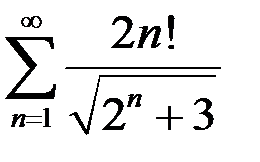 . 3.27.
. 3.27.  .
.
3.28.  . 3.29.
. 3.29.  . 3.30.
. 3.30.  .
.
4.1.  . 4.2.
. 4.2.  . 4.3.
. 4.3. 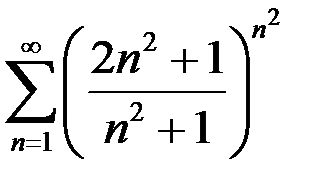 .
.
4.4.  . 4.5.
. 4.5.  . 4.6.
. 4.6.  .
.
4.7.  . 4.8.
. 4.8.  . 4.9.
. 4.9.  .
.
4.10.  . 4.11.
. 4.11. 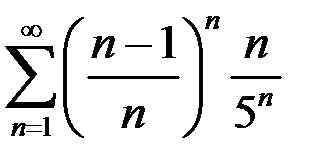 . 4.12.
. 4.12.  .
.
4.13.  . 4.14.
. 4.14.  . 4.15.
. 4.15.  .
.
4.16.  . 4.17.
. 4.17.  . 4.18.
. 4.18.  .
.
4.19.  . 4.20.
. 4.20.  . 4.21.
. 4.21.  .
.
4.22.  . 4.23.
. 4.23.  . 4.24.
. 4.24.  .
.
4.25.  . 4.26.
. 4.26.  . 4.27.
. 4.27.  .
.
4.28. 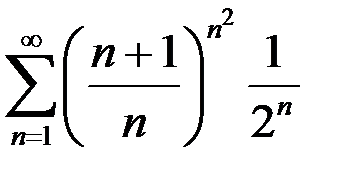 . 4.29.
. 4.29.  . 4.30.
. 4.30.  .
.
6.1. 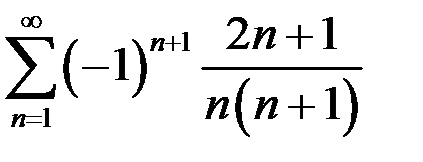 . 6.2.
. 6.2.  . 6.3.
. 6.3. 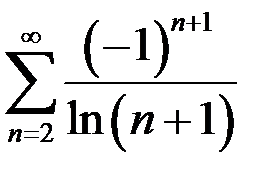 .
.
6.4. 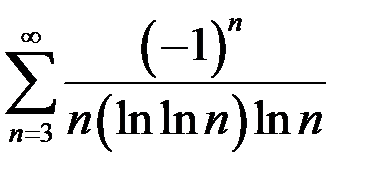 . 6.5.
. 6.5.  . 6.6.
. 6.6. 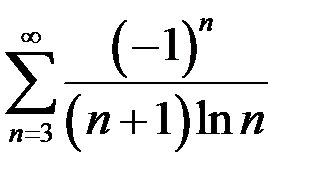 .
.
6.7.  . 6.8.
. 6.8. 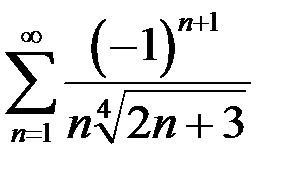 . 6.9.
. 6.9.  .
.
6.10.  . 6.11.
. 6.11.  . 6.12.
. 6.12.  .
.
6.13.  . 6.14.
. 6.14.  . 6.15.
. 6.15.  .
.
6.16.  .6.17.
.6.17.  . 6.18.
. 6.18.  .
.
6.19.  . 6.20.
. 6.20.  . 6.21.
. 6.21.  .
.
6.22.  . 6.23.
. 6.23.  . 6.24.
. 6.24. 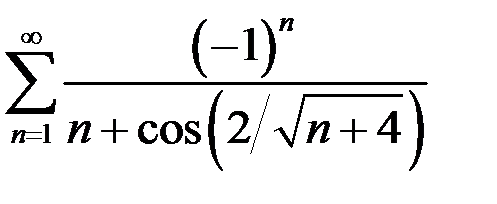 .
.
6.25.  . 6.26.
. 6.26.  . 6.27.
. 6.27.  .
.
6.28.  . 6.29.
. 6.29.  . 6.30.
. 6.30.  .
.
| 1.
| 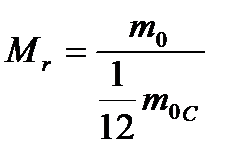
| Относительная молекулярная (атомная) масса.
|
| mo – масса 1 молекулы вещества, moс – масса атома углерода 12С.
|
| 2.
| 
| Молярная масса.
|
| mo – масса 1 молекулы (атома) вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1.
|
| 3.
| 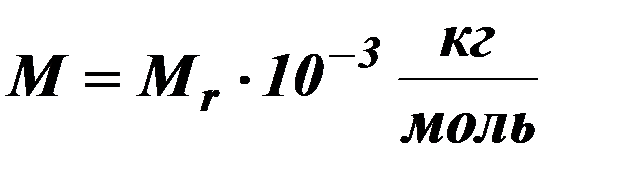
| Связь молярной с относительно молекулярной массой.
|
| Мr –относительно молекулярная масса.
|
| 4.
| 
| Масса любого вещества.
|
| mo – масса 1 молекулы вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества (моль), N – количество молекул.
|
| 5.
| 
| Количество вещества.
|
| m – масса вещества, Na – постоянная Авогадро, Na = 6∙1023 моль-1, М – молекулярная масса, ν – количество вещества, N – количество молекул.
|
| 6.
|  
| Уравнение Клаузиуса. Основное уравнение МКТ.
|
| Р – давление, mo – масса 1 молекулы вещества, n – концентрация, ͞ν2 – квадрат средней квадратичной скорости.
|
| 7.
| 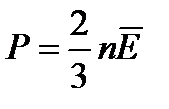
| Связь давления со средней кинетической энергией. Основное уравнение МКТ.
|
| n – концентрация, Е- средняя кинетическая энергия поступательного движения.
|
| 8.
| 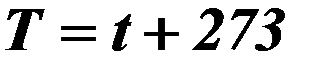
| Абсолютная температура (термодинамическая температура или температура по шкале Кельвина)
|
| Т – абсолютная температура (К), t – температура по Цельсию.
|
| 9.
| 
| Температура-мера средней кинетической энергии. Формула Больцмана.
|
| Е- средняя кинетическая энергия поступательного движения, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура.
|
| 10.
| 
| Давление через концентрацию и температуру.
|
| Р – давление, n – концентрация, R – универсальная газовая постоянная,
R = 8,31 Дж/моль∙К, Т – абсолютная температура.
|
| 11.
| 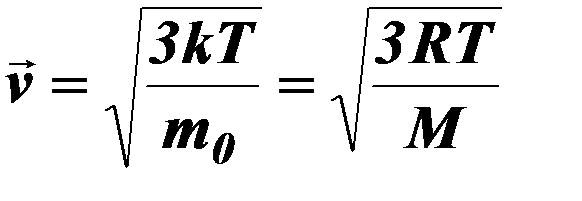
| Средняя квадратичная скорость.
|
| R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура, mo – масса 1 молекулы вещества, М – молекулярная масса, к – постоянная Больцмана, к = 1,38∙1023 Дж/К.
|
| 12.
| 
| Закон Дальтона (давление смеси газов).
|
| Р1 – парциальное давление первого газа (Па), Р2 – парциальное давление второго газа (Па).
|
| 13.
| 
| Уравнение состояния идеального газа. (Уравнение Менделеева – Клапейрона)
|
| Р – давление, V – объём газа, m – масса газа, М – молекулярная масса, R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К, Т – термодинамическая температура(К)..
|
| 14.
| 
| Уравнение Клапейрона, (объединенный газовый закон).
|
| Р – давление (Па), V – объём газа (м3), Т – термодинамическая температура
|
| 15.
| 
| Изотермический процесс.
|
| Р – давление, V – объём газа.
|
| 16.
| 
| Изобарный процесс.
|
| V – объём газа, Т – термодинамическая температура.
|
| 17.
| 
| Изохорный процесс.
|
| Р – давление, Т – термодинамическая температура.
|
| 18.
| 
| Абсолютная влажность воздуха.
|
| ρ- абсолютная влажность (г/м3), V – объём газа, m – масса водяного пара.
|
| 19.
| 
| Относительная влажность воздуха.
|
| Р – парциальное давление водяного пара при данной температуре, Рн.п. – давление насыщенного пара при той же температуре, n – концентрация водяного пара, nн.п. – концентрация насыщенного пара, ρ- абсолютная влажность, ρн.п. – плотность насыщенного пара.
|

 .)
.) 1.2.
1.2. 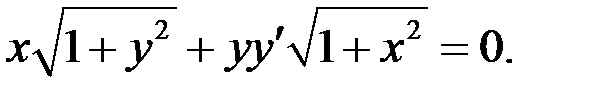
 1.4.
1.4. 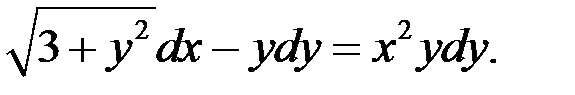
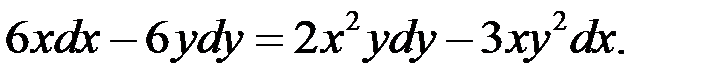 1.6.
1.6. 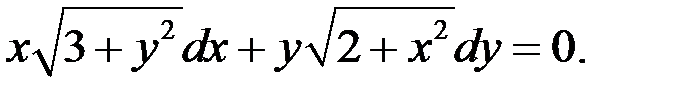
 1.8.
1.8. 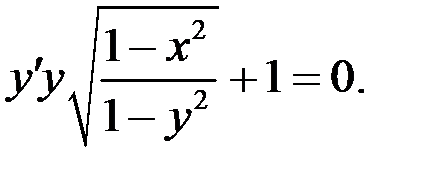
 1.10.
1.10. 
 1.12.
1.12. 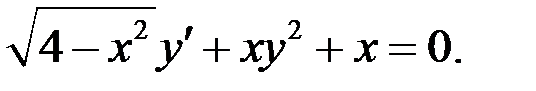
 1.14.
1.14. 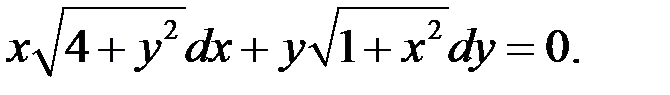
 1.16.
1.16. 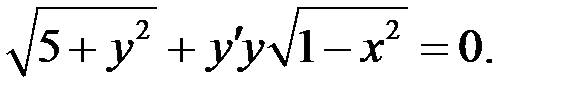
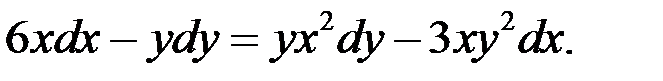 1.18.
1.18. 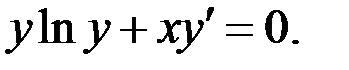
 1.20.
1.20. 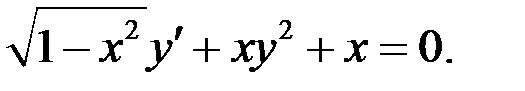
 1.22.
1.22. 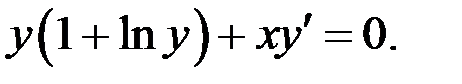
 1.24.
1.24. 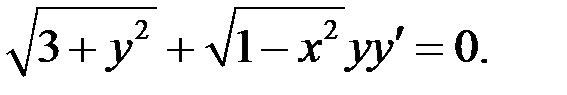
 1.26.
1.26. 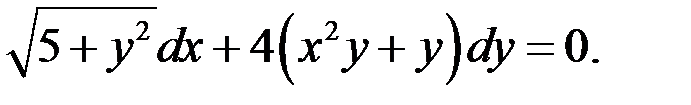
 1.28.
1.28. 
 1.30.
1.30. 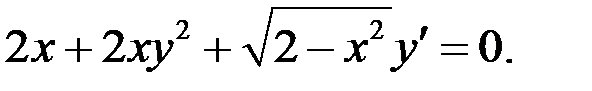
 2.2.
2.2.  2.3.
2.3. 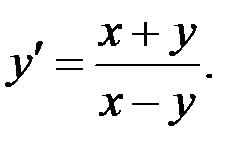
 2.5.
2.5.  2.6.
2.6. 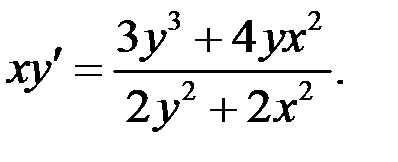
 2.8.
2.8.  2.9.
2.9. 
 2.11.
2.11.  2.12.
2.12. 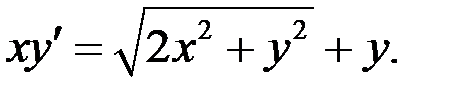
 2.14.
2.14. 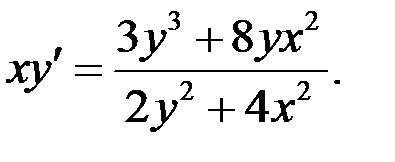 2.15.
2.15. 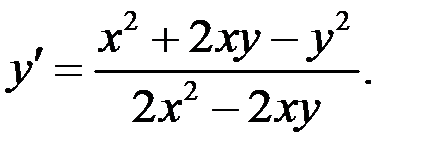
 2.17.
2.17.  2.18.
2.18. 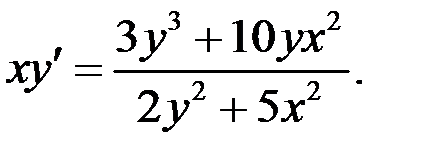
 2.20.
2.20.  2.21.
2.21. 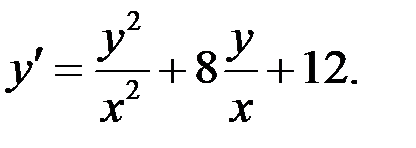
 2.23.
2.23.  2.24.
2.24. 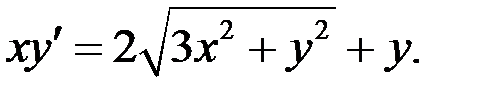
 2.26.
2.26.  2.27.
2.27. 
 2.29.
2.29.  2.30.
2.30. 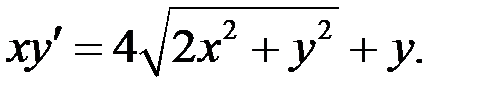
 . 2.2.
. 2.2.  . 2.3.
. 2.3. 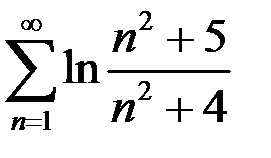 .
.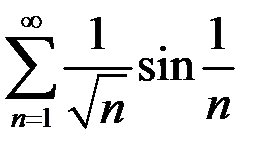 . 2.5.
. 2.5.  . 2.6.
. 2.6.  .
. . 2.8.
. 2.8.  . 2.9.
. 2.9. 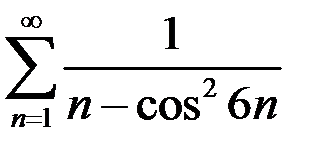
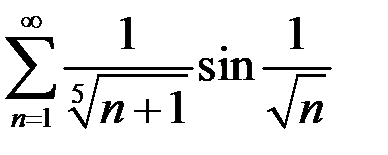 . 2.11.
. 2.11.  . 2.12.
. 2.12. 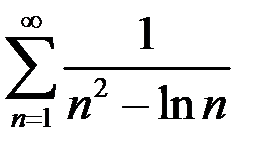 .
.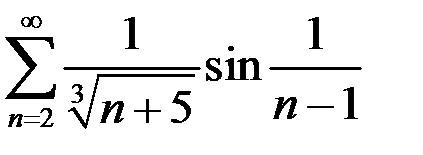 . 2.14
. 2.14 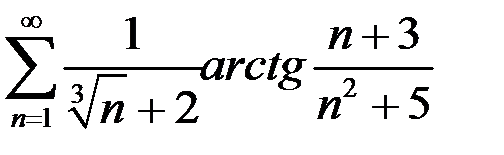 . 2.15.
. 2.15.  .
. .2.17.
.2.17.  . 2.18.
. 2.18.  .
. . 2.20.
. 2.20.  .2.21.
.2.21.  .
. . 2.23.
. 2.23.  . 2.24.
. 2.24.  .
. . 2.26.
. 2.26.  . 2.27.
. 2.27.  .
. . 2.29.
. 2.29. 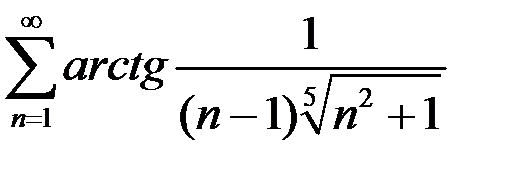 . 2.30.
. 2.30.  .
. . 3.2.
. 3.2. 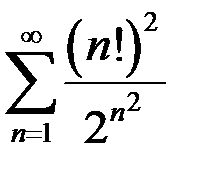 . 3.3.
. 3.3.  .
. . 3.5.
. 3.5.  . 3.6.
. 3.6.  .
. . 3.8.
. 3.8.  . 3.9.
. 3.9. 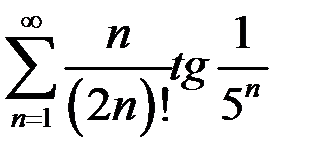 .
.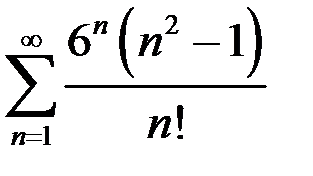 . 3.11.
. 3.11.  . 3.12.
. 3.12.  .
. . 3.14.
. 3.14.  . 3.15.
. 3.15.  .
. . 3.17.
. 3.17.  . 3.18.
. 3.18.  .
.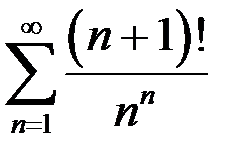 . 3.20.
. 3.20. 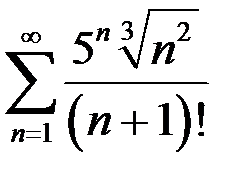 . 3.21.
. 3.21. 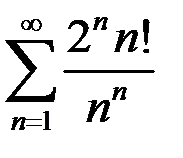 .
.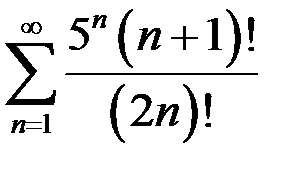 . 3.23.
. 3.23. 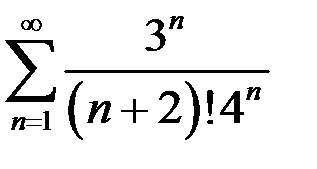 . 3.24.
. 3.24.  .
. . 3.26.
. 3.26. 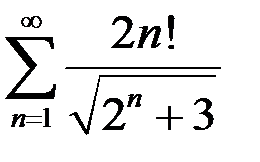 . 3.27.
. 3.27.  .
. . 3.29.
. 3.29.  . 3.30.
. 3.30.  .
. . 4.2.
. 4.2.  . 4.3.
. 4.3. 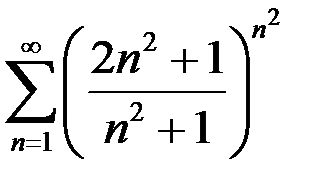 .
. . 4.5.
. 4.5.  . 4.6.
. 4.6.  .
. . 4.8.
. 4.8.  . 4.9.
. 4.9.  .
. . 4.11.
. 4.11. 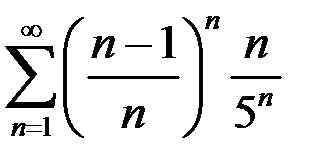 . 4.12.
. 4.12.  .
. . 4.14.
. 4.14.  . 4.15.
. 4.15.  .
. . 4.17.
. 4.17.  . 4.18.
. 4.18.  .
. . 4.20.
. 4.20.  . 4.21.
. 4.21.  .
. . 4.23.
. 4.23.  . 4.24.
. 4.24.  .
. . 4.26.
. 4.26.  . 4.27.
. 4.27.  .
.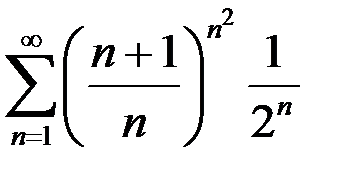 . 4.29.
. 4.29.  . 4.30.
. 4.30.  .
.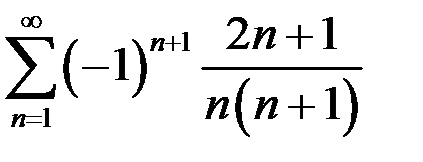 . 6.2.
. 6.2.  . 6.3.
. 6.3. 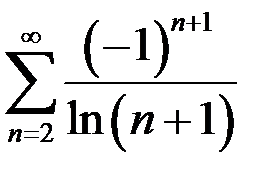 .
.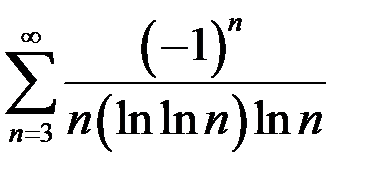 . 6.5.
. 6.5.  . 6.6.
. 6.6. 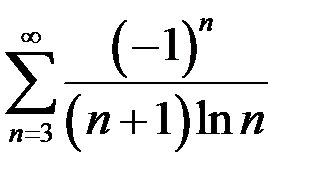 .
. . 6.8.
. 6.8. 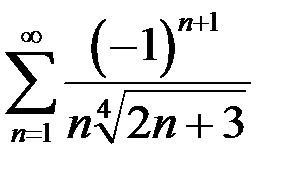 . 6.9.
. 6.9.  .
. . 6.11.
. 6.11.  . 6.12.
. 6.12.  .
. . 6.14.
. 6.14.  . 6.15.
. 6.15.  .
. .6.17.
.6.17.  . 6.18.
. 6.18.  .
. . 6.20.
. 6.20.  . 6.21.
. 6.21.  .
. . 6.23.
. 6.23.  . 6.24.
. 6.24. 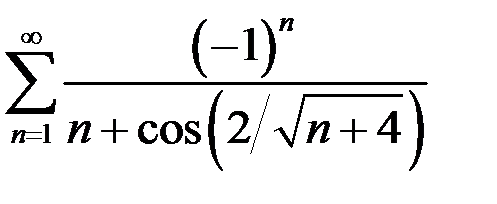 .
. . 6.26.
. 6.26.  . 6.27.
. 6.27.  .
. . 6.29.
. 6.29.  . 6.30.
. 6.30.  .
.