Способы определения молярной массы газов
Существует ряд методов определения молекулярной массы газов при определенных внешних параметрах: давлении (Р), объеме (V) и температуре (Т). 1. По закону Авогадро и следствиям из него Закон Авогадро: в равных объемах различных газов при одинаковых температуре и давлении содержится одинаковое число молекул. Следствие 1: один моль любого вещества содержит количество структурных единиц данного вещества, равное постоянной Авогадро (Na = 6,02∙1023 моль-1). Следствие 2: при нормальных условиях (н.у.) (Р = 105 Па, Т = 273 К) один моль любого газа занимает объем 22,4 л. Эта величина получила название молярный объем (VM). Зная массу m (г) какого-либо объема газа при н.у. и его объем V0 (л), можно рассчитать его молекулярную массу.
Следствие 3: массы равных объемов двух газов, взятых при одинаковых давлении и температуре, относятся друг к другу, как их молярные массы:
Отношение массы определенного объема первого газа к массе такого же объема второго газа (взятого при тех же условиях) называется относительной плотностью первого газа по второму (D). Тогда:
Обычно плотность газа определяют по отношению к водороду (D H2) или воздуху (
С учётом вышеуказанных условий для расчёта количества вещества используют следующие соотношения:
где N – количество структурных единиц в системе;
где VM – молярный объём. 2. По уравнению Клапейрона – Менделеева Если условия, в которых находится газ, отличны от нормальных, то параметры газа определяют по уравнению Клапейрона – Менделеева:
Единицы измерения величин в данном уравнении зависят от того, в каких единицах выражена масса (табл.1.2.1). Таблица 2.3.1 Единицы измерения величин в уравнении Менделеева-Клапейрона
|

 .
.
 .
.
 .
.
 .). Тогда:
.). Тогда: · 2,
· 2,
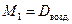 М возд. =
М возд. =  ,
,
 ,
,
 ,
,
 .
.





