Закон сохранения массы веществ.
Расчёты по химическим уравнениям
Закон сохранения массы веществ независимо друг от друга открыли сначала М.В. Ломоносов, затем А. Лавуазье: масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции. Запишем схему горения метана в кислороде:
По закону сохранения массы:
Сохранение массы вещества в химических реакциях объясняется тем, что число атомов каждого элемента до и после реакции не изменяется, происходит только перегруппировка атомов. Для сохранения числа атомов каждого элемента в схеме (1) расставим следующие коэффициенты:
Выражение (2) называют уравнением химической реакции (химическим уравнением). Химическое уравнение – это выражение химической реакции, в которой записаны формулы исходных веществ (реагентов) и продуктов реакции, а также стехиометрические коэффициенты, которые показывают не только число молекул, но и число молей реагентов и продуктов реакции. На основе правильно составленных уравнений реакций можно проводить количественные расчеты – определять количества и массы реагентов и продуктов, если заданы количество или масса одного из веществ, участвующих в реакции. В количественных расчётах состава смеси часто используют понятие массовой доли. Массовая доля вещества (ω) – это отношение массы вещества в системе к массе всей системы. Массовая доля вещества может быть выражена в долях единицы или в процентах:
|

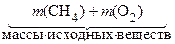 =
= 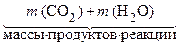 .
. ;
;



