Опыт 3. Электролиз водного раствора сульфата меди (II) с активным медным анодом
Поменять местами электроды (опыт 2), вследствие чего анод окажется омеднённым. Снова пропустить электрический ток. - Отметить, какие изменения происходят на электродах:
- составить уравнения электролитической диссоциации CuSO4 и H2O: CuSO4
H2O - составить уравнение гидролиза CuSO4 в растворе;
- в растворе CuSO4………………….. среда - возможные окислители:…………………… - выбрать окислитель, характеризующийся наибольшим значением окислительно-восстановительного потенциала:
- составить уравнение катодной реакции: (процесс …………….…); - возможные восстановители:……………….. - выбрать восстановитель, характеризующийся наименьшим значением окислительно-восстановительного потенциала:
- составить уравнение анодной реакции: (процесс ………………...);
- составить суммарное уравнение электролиза раствора сульфата меди (II) с активным медным анодом, объединив уравнения катодной и анодной реакций с учетом коэффициентов электронного баланса:
- ответить, каковы области практического использования электролиза водных растворов солей с активным анодом:
Вывод:
Уфимский государственный нефтяной технический университет
Кафедра «Общая и аналитическая химия»
Дисциплина «Общая и неорганическая химия»
ОТЧЕТ
по лабораторной работе №3,4
на тему: «Общие свойства металлов»
|


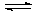
 + 0,34 В
+ 0,34 В 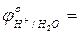 - 0,41 … 0,0 В;
- 0,41 … 0,0 В;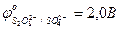
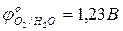 …0,82 В
…0,82 В 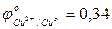 В;
В; (ионное уравнение);
(ионное уравнение); (молекулярное уравнение);
(молекулярное уравнение);


