Почвенные коллоиды, их образование, состав и свойства
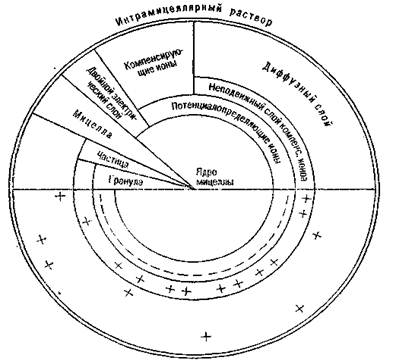
Почву относят к сложной полидисперсной системе – в ее состав входят частицы различного размера. Исключительно важную роль играет высокодисперсная часть почвы. Она представлена частицами, имеющими размер меньше 0,0001 мм. Их содержание в почве может колебаться от 1–2% до 30–40% к массе почвы. Значение высокодисперсной части почвы состоит в том, что она во многом определяет физические и водно-физические свойства почвы, режим питания растений, поглотительную способность почвы. Высокодисперсная часть почвы состоит преимущественно из коллоидов. Почвенные коллоиды – совокупность почвенных частичек размером от 1 до 100 нм. Таким образом, коллоидные растворы занимают промежуточное положение между истинными, или молекулярными растворами (размер частичек < 1нм), с одной стороны, и суспензионными, эмульсионными (размер частичек > 100 нм), с другой. Происхождение почвенных коллоидов может быть связано с По составу бывают: · минеральные, · органические, · органоминеральные коллоиды. Минеральные коллоиды представлены преимущественно глинистыми, а также некоторыми первичными минералами (например, кварц), измельченными до коллоидного состояния. Кроме того, минеральные коллоиды образуют гидрооксиды кремния SiO2 • пН2О; железа Fe(OH)3 • пН2О, алюминия А1(ОН)3 • п Н2О, марганца Мп2О3 • пН2О. На долю минеральных коллоидов приходится около 80–90 % от массы всех коллоидов почвы. Органические коллоиды образуются при гумификации органического вещества. Представлены в почве гумусовыми кислотами и их солями: гуматами, фульватами, алюмо-железогумусовыми соединениями. При взаимодействии гумуса с высокодисперсными минералы частичками почвы образуются комплексные соединения сложного состава – органоминеральные коллоиды. Количество коллоидов в почве может сильно колебаться в зависимости от содержания в ней гумусовых веществ и частичек физической глины, с их увеличением возрастает количество коллоидов. Коллоидная система почвы состоит из дисперсной фазы (масса коллоидных частичек) и дисперсионной среды (почвенного раствора), они взаимодействуют, в результате этого вокруг коллоидной частички создается двойной ионогенный слой. Коллоидную частичку с двойным ионогенным слоем называют мицеллой. Общая схема ее строения дана на рисунке 1.
Рис. 1. Схема строения коллоидной мицеллы (по Н.И. Горбунову)
Внутри мицеллы находится ядро – масса недисоциированных молекул коллоидообразующего вещества. К ядру примыкает потенциалопределяющий (внутренний) слой ионов определенного электрического заряда. Он неподвижный, прочно связан с ядром. Ядро вместе с потенциалопределяющим слоем образует гранулу. Вокруг нее формируется слой компенсирующих ионов, имеющих противоположный заряд по сравнению с ионами внутреннего слоя. Часть его ионов образует неподвижный слой компенсирующих ионов, другая часть отходит от внутреннего слоя на значительное расстояние, теряет с ним прочную связь и образует диффузный слой. Ионы диффузионного слоя способны к различным обменным реакциям с почвенным раствором. При потере диффузным слоем части ионов между зарядами слоя потенциалопределяющих ионов и слоем компенсирующих ионов возникает определенная разность потенциалов, называемая дзета-потенциалом. Величина его колеблется от 0 до 40–60 мВ. Основная масса мицеллы принадлежит грануле, поэтому заряд последней рассматривается как заряд всего коллоида. Коллоиды, имеющие во внутреннем слое отрицательно заряженные ионы и диссоциирующие в раствор Н-ионы, называются ацидоидами. Они способны к поглощению и обмену катионов. Положительным зарядом характеризуются базоиды – их потенциалопределяющий слой состоит из катионов, а диффузный – из ОН-ионов (анионов). Базоиды способны поглощать и обменивать анионы. Некоторые коллоиды (гидроксиды железа, алюминия) при изменении реакции среды меняют и знак заряда: в кислой среде они заряжены положительно, а в щелочной – отрицательно. Такие коллоиды называют амфолитоидами. Большинство почвенных коллоидов являются ацидоидами – это коллоиды гумусовых веществ, глинистых минералов и кремнекислоты. К базидам можно отнести гидрооксиды алюминия, железа. Взаимодействию и соединению коллоидных частиц препятствуют водные пленки, образующиеся на их поверхности. По количеству воды, которую удерживают коллоиды, они подразделяются на гидрофильные и гидрофобные. Первые сильно гидротируются, набухают в воде. К ним относятся коллоиды гумуса, глинистых минералов. Гидрофобные коллоиды удерживают небольшое количество воды – это минералы каолинитовой группы и др. Почвенные коллоиды могут находиться в двух состояниях: золя или коллоидного раствора, и геля или студенистого, комковатого или аморфного осадка. Под влиянием тех или других факторов коллоиды из состояния раствора могут переходить в осадок и наоборот. Процесс соединения отдельных коллоидных частичек и выпадения осадка называется коагуляцией. Осадок, образующийся при коагуляции, называется гелем. Переход геля в золь – пептизация. Коагуляцию почвенных коллоидов могут вызывать и такие явления, как старение коллоидов, обезвоживание и замораживание почв. Коагулированные коллоиды могут переходить от состояния геля в золь. Обычно это происходит с гидрофильными коллоидами, насыщенными одновалентными катионами – Н-, NH4+,Na+, и др. В этих условиях не может образоваться водопрочная структура почвы. Коллоиды передаются вниз по профилю, что может ухудшить физико-химические свойства почвы. Переход геля в золь затруднен или вообще невозможен для гидрофобных коллоидов, насыщенных двух- и трехвалентными катионами – Са2+, Mg2+, A13+, Fe3+. В таких условиях пептизации коллоидов почти не наблюдается, образуются водопрочные структурные агрегаты, в почве закрепляются гумусовые вещества. Почвенные коллоиды являются носителями сорбционных свойств почвы. Они способны поглощать и обменивать ионы диффузного слоя мицеллы на ионы почвенного раствора. Адсорбционные свойства коллоидов обусловлены большой удельной поверхностью, благодаря которой коллоидные частички приобретают силы электростатического притяжения – вокруг их могут концентрироваться молекулы воды, газов и др.
|