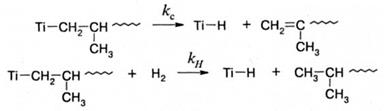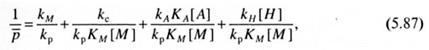Полимеризация на гетерогенных катализаторах Циглера-Натта
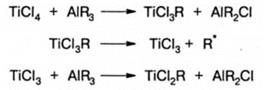
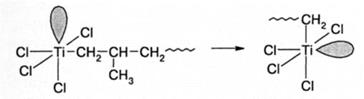
Формально в большинстве случаев полимеризация на катализаторах Циглера-Натта может быть отнесена к анионно-координационной. Это относится, прежде всего, к полимеризации неполярных мономеров, таких как этилен, α-олефины, стирол. Мономеры с электронодонорными заместителями, такие как α-метилстирол или изобутилен, а также винилацетат и акрилаты полимеризуются по катионному или анионному механизму (в зависимости от полярности двойной связи), но при свободном росте цепи. Мономеры основного характера «отравляют» катализаторы Циглера-Натта. Катализатор Циглера-Натта образуется в результате сложных процессов, развивающихся при смешении компонентов катализатора. На поверхности кристаллов TiCl3 (TiCl4) образуется нерастворимый координационный комплекс, в котором TiCl4 (TiCl3) является донором, a AlR3 - акцептором электронов. Образование комплекса сопровождается рядом реакций, из которых наиболее значима реакция алкилирования переходного металла, поскольку в дальнейшем присоединение мономера в реакции роста происходит по связи Ti-C:
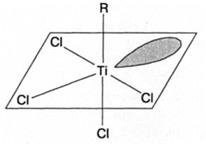
В ходе восстановления Ti4+ до Ti3+ образуются радикалы, что объясняет известные факты инициирования радикальной полимеризации некоторых мономеров катализаторами Циглера-Натта. Существуют две модели активного центра на гетерогенном катализаторе Циглера-Натта: моно- и биметаллическая. Согласно первой модели, активные центры, включающие связь Ti-C, локализованы на поверхности одной из кристаллических модификаций TiCl3. Атом титана активного центра имеет пять лигандов и одну вакантную октаэдрическую орбиталь. Четыре лиганда - атомы хлора - он делит с соседними атомами титана кристаллической решетки, пятым является углеводородный радикал или растущая полимерная цепь. В целом, ориентация лигандов и вакантной орбитали атома титана активного центра соответствует октаэдру:
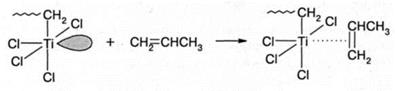
Реакции инициирования и роста в полимеризации на катализаторах Циглера-Натта практически не отличаются, поскольку во всех случаях имеет место внедрение мономера по связи Ti-C. Выделяют три стадии этой реакции. На первой стадии мономер координируется на атоме титана октаэдри-ческого активного центра за счет свободной орбитали:
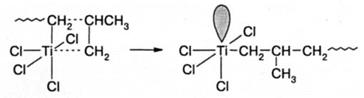
На второй стадии координированный мономер внедряется по связи Ti-C. При этом вакантная орбиталь регенерируется, однако, ее пространственное положение изменяется, что хорошо видно из схемы:
В результате в следующем акте роста мономер должен был бы присоединиться в другой стереохимической конфигурации. Факты, однако, указывают на то, что при полимеризации на катализаторах Циглера-Натта пропилен присоединяется всегда в одной и той же пространственной конфигурации, что приводит к формированию изотактической структуры цепи. Из этого следует необходимость существования третьей стадии, в ходе которой восстанавливается исходное пространственное положение вакантной орбитали:
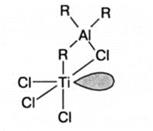
Биметаллический активный центр отличается от монометаллического тем, что атомы непереходного и переходного металлов, как это видно из приведенной схемы, имеют общие лиганды:
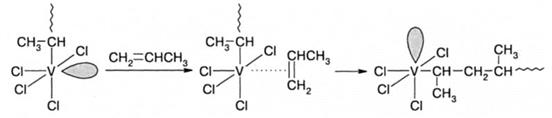
Считается, что атом непереходного металла стабилизирует биметаллический активный центр. В основном механизм присоединения остается тем же, что и рассмотренный выше. Механизм стереорегулирования в обоих случаях обусловлен объемными и электростатическими взаимодействиями заместителя при двойной связи мономера и окружения титана, т.е. лигандов переходного металла. Синдиотактическая полимеризация менее характерна для катализаторов Циглера-Натта, она реализована для пропилена, стирола и бутадиена на растворимых катализаторах, наиболее распространенными из которых являются VCl4-Al(C2H5)3 и дициклопентадиенильные производные титана в комбинации с AIR3. Полимеризация проводится при низкой температуре от -40 до -78°С, поскольку уменьшение последней приводит к увеличению выхода синдиотактической структуры полимера. Механизмы стереорегулирования при изо- и синдио-присоединении имеют также общие черты. В обоих случаях образуется октаэдрический комплекс переходного металла, имеющий вакантную орбиталь, при этом мономер присоединяется по связи переходный металл-углерод:
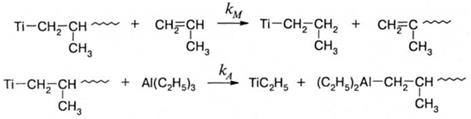
При стереорегулярной синдиотактической полимеризации, в отличие от рассмотренной выше изотактической, отсутствует стадия миграции растущей цепи в координационной сфере атома ванадия, поэтому ориентация вакантной орбитали изменяется после каждого акта присоединения мономера. Это способствует последовательной смене пространственной конфигурации присоединяющихся мономерных звеньев. Как уже говорилось, синдио-присоединение является энергетически более выгодным из-за отталкивания метильных групп мономера и концевого звена. Это взаимодействие, а также отталкивание метильной группы конечного звена и лигандов координационной сферы ванадия препятствуют вращению вокруг связи V-C и стабилизируют пространственное положение конечного звена. Реакции передачи и обрыва цепи оказывают заметное влияние на полимеризацию в присутствии катализаторов Циглера-Натта. Наиболее значимы реакции передачи цепи на мономер и алкилы непереходного металла:
а также реакции спонтанного обрыва и обрыва на соединениях с подвижным атомом водорода, включая молекулярный водород:
Последнюю реакцию используют в промышленности для регулирования молекулярной массы полимера. Ни одна из приведенных выше реакций не обрывает кинетическую цепь, т.к. титансодержащий продукт реакции способен к реинициированию. Поэтому полимеризацию, инициируемую катализаторами Циглера-Натта, можно рассматривать как живую полимеризацию. При полимеризации на гомогенных катализаторах Циглера-Натта скорость полимеризации может быть выражена, как обычно, через скорость роста цепи:
где [С*] - концентрация активных центров. При полимеризации, инициируемой гетерогенными катализаторами, необходимо учитывать закономерности адсорбции мономера и сокатализатора на поверхность TiCl3. В простейшем случае, когда сокатализатор не оказывает влияния на адсорбцию мономера, а последняя описывается изотермой Ленгмюра, имеем:
где [М] - концентрация мономера в жидкой фазе; КM - константа равновесия адсорбции мономера на гетерогенном катализаторе. Степень полимеризации выражается, как обычно, делением скорости роста на сумму скоростей обрыва материальной цепи. С учетом четырех рассмотренных ранее реакций передачи и обрыва цепи для обратной степени полимеризации имеем:
где kM kA - константы скорости реакций передачи цепи на мономер и алкил непереходного металла, kс, kH - константы скорости обрыва - спонтанного и на молекулярном водороде (или на соединениях с подвижным атомом водорода), КА - константа адсорбции алкила непереходного металла, [Н] -концентрация водорода или соединения с подвижным атомом водорода в зоне реакции.
|