Примеры решения задач. Пример 1. Как изменится скорость реакции 2NО(г) + О2(г) ⇄ 2NO2(г), если одно-временно концентрацию NО увеличить в 2 раза
Пример 1. Как изменится скорость реакции 2NО(г) + О2(г) ⇄; 2NO2(г), если одно-временно концентрацию NО увеличить в 2 раза, а концентрацию О2 уменьшить в 8 раз? Р е ш е н и е. 1) Зависимость скорости химической реакции от концентрации реагирующих веществ выражается законом действующих масс, поэтому записываем математическое выражение этого закона для данной реакции в начальный момент времени: Согласно условию концентрацию NO увеличили в 2 раза, т.е. С'NO=2С NO, а концентрацию О2 уменьшили в 8 раз, т.е. С'o2 = Сo2 /8. 2) Записываем выражение для скорости реакции в конечный момент времени: υ' = k × (С' NO)2 × С'o2 или 3) Ответ: при одновременном увеличении концентрации NО в 2 раза и уменьшении концентрации О2 в 8 раз скорость реакции уменьшается в 2 раза. Пример 2. Определите, во сколько раз изменятся скорости прямой и обратной реакций в системе 2SO2 (г) + О2 (г) ⇄ 2SО3 (г), если объем газовой смеси уменьшить в 3 раза. Каково направление смещения равновесия в этой системе? Р е ш е н и е. 1) Записываем выражения для скоростей прямой и обратной реакций, используя закон действующих масс: 2) Рассматриваем, что происходит в реакционной системе при уменьшении ее объема. Уменьшение объема гомогенной системы в 3 раза приводит к увеличению концентрации каждого из реагирующих веществ также в 3 раза, т.е. математически это записываем в виде: С'so2 = 3С so2, С'о2 = 3Сo2 и С'so3 = 3С so3. 3) Записываем выражение для скоростей прямой и обратной реакций после изменения объема системы:
4) Определяем, во сколько раз изменяются скорости прямой и обратной реакций: Таким образом, при уменьшении объема газовой смеси в 3 раза скорость прямой реакции увеличится в 27 раз, а скорость обратной реакции – в 9 раз. 5) Устанавливаем направление смещения равновесия в этой системе. В связи с тем, что скорость прямой реакции увеличилась в 27 раз, а обратной – только в 9 раз, равновесие сместится в направлении протекания прямой реакции, т.е. в сторону образования SO3. Пример 3. Рассчитайте температурный коэффициент скорости химической реакции, если известно, что константа скорости этой реакции при 140°С равна 5,5 × 10-4, а при 185°С – 9,2 × 10-3. Дано: Т1 =140° С, k1 =5,5 × 10 -4; Т2= 185°С, k2 = 9,2∙× 10-3. Найти γ. Р е ш е н и е. 1) Зависимость скорости химической реакции от температуры описывается правилом Вант-Гоффа в форме: Но для проведения расчетов это уравнение необходимо прологарифмировать, т.е. 2) Рассчитываем температурный коэффициент скорости этой реакции. а) вычисляем температуру по абсолютной шкале: T1 = 140 + 273 = 413 К, Т2 = 185 + 273 = 458 К; б) рассчитаем численное значение γ:
отсюда Ответ: температурный коэффициент этой реакции равен 1,87. Пример 4. При синтезе аммиака N2 + ЗН2 ⇄; 2NНз равновесие установилось при следующих концентрациях реагирующих веществ (моль/л) [ N2 ] = 4; [ H2 ] = 2 и [ NH3 ] = 6. Рассчитайте константу равновесия и исходные концентрации Н2 и N2. Дано: [ Н2 ]=2 моль/л, [ N2 ] = 4 моль/л, [ NH3 ] = 6 моль/л. Найти Кс, Сисх (Н2), Cиcx (N2). Р е ш е н и е. 1) Записываем выражение для константы равновесия в этой системе и рассчитываем ее значение: 2) Определяем исходные концентрации Н2 и N2. Для обратимых реакций ни одно из реагирующих веществ не расходуется полностью. Поэтому исходная концентрация вещества А складывается из равновесной концентрации этого вещества [А] и концентрации этого вещества, которая была израсходована на реакцию к моменту установления равновесия (условно обозначим ее X (А). Таким образом, выражение для исходной концентрации вещества А может быть представлено в виде: Сисх(А) = [А] + Х(А). а) Для определения Сисх(N2) и Сисх(Н2) обращаемся к уравнению реакции, согласно которому на образование 2 моль NH3 требуется 1 моль N2 и 3 моль Н2. Но поскольку равновесная концентрация NH3 равна 6 моль/л, то при этом было израсходовано 6/2 = 3 моль N2 и 3×(6 / 2) = 9 моль Н2. б) Рассчитаем Сисх(N2) и Сисх(Н2): Сисх(Н2) = [Н2] + Х(Н2) = 2 + 9 = 11 моль/л, Cисх(N2) = [N2] + X(N2) = 4 + 3 = 7 моль/л. Ответ: константа равновесия реакции равна 1,1. Исходные концентрации Н2 и N2 составляют 11 моль/л и 7 моль/л соответственно. Пример 5. Установите направление смещения равновесия в системе 2Н2О(г)+ 2О2(г) ⇄; 2Н2О2 (г), ∆ Н = – 483,7 кДж при понижении температуры и уменьшении общего давления. Р е ш е н и е. Влияние внешнего воздействия на состояние химического равновесия в системах, в которых протекают обратимые реакции, оценивается с помощью принципа Ле Шателье-Брауна. 1) Рассматриваем влияние температуры на состояние равновесия в данной системе. Термохимическое уравнение реакции показывает, что ∆Н < 0, следовательно, прямая реакция экзотермическая. При понижении температуры согласно принципу 2) Оцениваем влияние изменения давления на состояние равновесия в данной системе. Из уравнения реакции видно, что прямая реакция сопровождается уменьшением объема системы 2V (Н2О) + 1V (О2) ≠ 2V (Н2О2), т.е. ∆V ≠ 0. Поэтому общее давление (Робщ) будет влиять на состояние равновесия в данной системе. Уменьшение Робщ согласно принципу Ле Шателье-Брауна вызовет противодействие системы (увеличение Робщ) за счет смещения равновесия в сторону протекания реакции, сопровождающейся увеличением Робщ, т.е. в сторону обратной реакции. Действительно, обратная реакция приводит к увеличению числа моль газообразных веществ в системе, а это значит, что при протекании обратной реакции Робщ в системе увеличивается.
|



 Определяем, как изменяется скорость реакции. Для этого рассматриваем отношение
Определяем, как изменяется скорость реакции. Для этого рассматриваем отношение  = 1/2
= 1/2 ,
, 

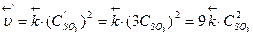
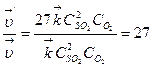 ;
; 

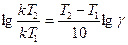
 , lg 16,7 = 4,5 lgγ;
, lg 16,7 = 4,5 lgγ; , т.е. lg γ = 0,27, и тогда γ = 1,87.
, т.е. lg γ = 0,27, и тогда γ = 1,87. ;
; 



