Растворы. Способы выражения концентрации растворов
Раствор – гомогенная (однородная) система, состоящая как минимум из двух компонентов, один из которых растворитель, другой – растворенное вещество. То есть состав раствора = растворитель + растворенное вещество. Например, водный раствор хлорида натрия состоит из двух компонентов: воды (растворителя) и хлорида натрия (растворенного вещества). Существует несколько способов выражения концентрации растворов. Молярная концентрация, или молярность (СM)– количество вещества (ν) растворенного компонента, содержащееся в 1 литре (дм3) раствора:
Молярная концентрация эквивалентов (Сэкв), (нормальная концентрация или нормальность N) – количество вещества эквивалентов (ν экв) растворенного компонента, содержащееся в 1 литре (дм3) раствора: Сэкв (N) = νэкв / V [моль-экв/л] (15) Моляльная концентрация или моляльность (b) – количество вещества (ν) растворенного компонента в 1 кг раствора:
Массовая доля (ω) – отношение массы растворенного вещества (mр.в .) к массе раствора (mр-ра) Ее рассчитывают, выражая в долях единицы или в процентах. Массовая доля, выраженная в процентах, называется процентной концентрацией:
Процентная концентрация показывает массу растворенного вещества, содержащегося в 100 г раствора. Например, ω(KOH) = 3% означает, что в 100 г этого раствора содержится 3 г KOH и 97 г H2O. Молярная доля (Ni) – отношение количества вещества растворенного компонента (nв-ва) (или растворителя, nр-ля) к суммарному количеству вещества всех компонентов раствора. Например, в системе, состоящей из растворителя и одного растворенного вещества, молярная доля растворенного вещества равна:
Молярная доля растворителя:
|

 [моль/л], (14)
[моль/л], (14)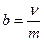 [моль/кг], (16)
[моль/кг], (16) (17)
(17) , (18)
, (18) (19)
(19)


