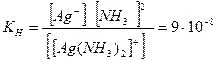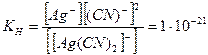Некоторые характеристики комплексных соединений
Теория кристаллического поля Основные положения: 1. Между комплексообразователем и лигандами существует электростатическое притяжение. 2. При сближении лигандов с комплексообразователем происходит изменение энергетического состояния d- орбиталей, которое зависит от их ориентации в пространстве
Схема энергетических уровней d-орбиталей центрального иона: а- свободный ион, б- ион в гипотетическом сферическом поле, в- ион в октаэдрическом поле лигандов.
Ориентация орбиталей dZ2 (а), dX2-У2(б), dXZ (в) в октаэдрическом поле лигандов (условно изображены в виде шариков) 3. Величина энергии расщепления ∆; зависит от природы комплексообразователя и лигандов, конфигурации комплекса. 4. Чем больше ∆;,тем прочнее комплекс. ∆ тем больше, чем больше заряд комплексообразователя и чем сильнее поле, создаваемое лигандами. По мере возрастания ∆;лиганды расположены в спектрохимический ряд: ЭДТА, En, CO, CN-, NH3, CNS-, H2O, OH-, F-, CI-, Br-, I- Сильное поле среднее слабое поле
Заполнение орбиталей происходит по принципам Паули и наименьшей энергии. Правило Хунда не всегда выполняется. Если ∆ >р, где р- это энергия, затрачиваемая на спаривание электронов, то правило Хунда не выполняется.
Пример
Распределение электронов в ионе Co 3+ по d-орбиталям: а) в гипотетическом сферическом поле лигандов, б) в слабом октаэдрическом поле лигандов (F-), в) в сильном октаэдрическом поле лигандов (CN-) Энергия расщепления ∆; может быть рассчитана как теоретически, так и по спектрам поглощения соединений. Е= hν = hc/λ; С другой стороны, зная ∆, можно рассчитать длину волны, частоту излучения и определить окраску соединения. Спектр поглощения (а следовательно, и окраска) обусловлен электронными переходами с низшей d- орбитали на d- орбиталь с более высокой энергией при наличии на последней вакантных мест. Если же вакантных мест нет, то соединение бесцветно. Таким образом объясняется тот факт, что большинство ионов d- элементов окрашены, не имеют окраски ионы, имеющие полностью заполненный d- подуровень. Наряду с этим теория кристаллического поля позволяет объяснить магнитные свойства соединений по наличию неспаренных электронов (парамагнитные свойства), либо их отсутствию (диамагнитные свойства). Ограниченность теории кристаллического поля: Не объясняет свойства комплексных соединений s- и p- элементов и d-элементов в высших степенях окисления. Метод молекулярных орбиталей Рассматривает комплекс как единую квантово-механическую систему, в которой отдельные атомы и молекулы теряют свои индивидуальные черты. Валентные электроны располагаются на многоцентровых МО, охватывающих ядра комплексообразователя и всех лигандов. Устойчивость комплексных соединений Устойчивость комплексных соединений характеризуется степенью диссоциации комплексных ионов, которая может быть выражена через константу равновесия, называемую константой нестойкости Кн. Чем больше величина этой константы, тем сильнее данный комплекс диссоциирует, тем менее он устойчив. Комплексное соединение [Ag(NH3)2]NО3 диссоциирует по ступеням: [Ag(NH3)2]NО3 = |Ag(NH3)2]+ + NОз‑ – первая ступень [Ag(NH3)2]+ Следует отметить, что диссоциация на ступени I происходит по типу диссоциации сильных электролитов, т.е. почти полностью, а диссоциация по ступени II идет лишь в незначительной степени, т.е. как у слабых электролитов, для которых константа нестойкости определяется по закону действия масс:
Процесс диссоциации и константа нестойкости комплексного иона [Ag(СN)2]‑ выражается следующим образом: [Ag(СN)2]‑
При сравнении величин констант нестойкости комплексных ионов видно, что аммиачный комплекс серебра менее прочный, чем цианидный, так как при диссоциации первого в раствор переходит больше свободных ионов, чем при диссоциации второго. Константы нестойкости некоторых комплексных ионов представлены в табл.2. Таблица.2.
|




 Ag+ + 2 NНз0 – вторая ступень.
Ag+ + 2 NНз0 – вторая ступень.