Общие сведения. Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных
Раствором называется гомогенная (однородная) система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в определенных пределах. По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. В растворах выделяют растворитель и растворенное вещество. Растворителем называют компонент, который образует непрерывную среду. остальные компоненты, которые распределены в среде растворителя в виде дискретных частиц, называются растворенными веществами. Состав раствора (концентрация) чаще всего выражается следующими способами. Массовая доля или процентное содержание w – соотношение масс растворенного m в вещества и раствора m р-р, выраженное в долях или процентах.
Концентрация, выраженная в граммах на литр, С г/л – показывает, какая масса растворенного вещества m в, выраженная в граммах, содержится в единице объема раствора V р-р:
Молярная концентрация или молярность, СМ – число молей растворенного вещества n в в одном дм3 (л) раствора:
Моляльная концентрация или моляльность, Сm – число молей растворенного вещества, приходящееся на один килограмм растворителя:
Мольная доля или мольные проценты xi – число молей компонента (растворителя или растворенного вещества) содержащееся в одном моле раствора:
Нормальная концентрация или нормальность, CN – количество эквивалентов растворенного вещества n эв, содержащееся в одном литре раствора:
где z – количество обменных эквивалентов растворенного вещества, содержащееся в одном его моле. Прием количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации, называют титрованием. Состояние системы, в котором аналитическая реакция прошла полностью в соответствии со стехиометрическим уравнением при отсутствии избытка реагента, называют точкой эквивалентности. Задача титрования – определить эквивалентный объем добавляемого реагента – титранта, необходимый для установления точки эквивалентности, так как в ней числа эквивалентов определяемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что число эквивалентов вещества в растворе равно произведению нормальности на объем раствора. Следовательно:
Отобрав для титрования мерной пипеткой точный объем пробы Vx, зная нормальность титранта До эквивалентной точки в ходе титрования в растворе присутствует избыток определяемого вещества, а после – избыток титранта. Поэтому в эквивалентной точке свойства раствора резко изменяются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить эквивалентный объем титранта.
|

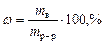 .
.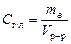 , г/л.
, г/л. , моль/л.
, моль/л. , моль/кг.
, моль/кг. .
. экв/л,
экв/л,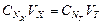 .
.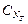 и определив эквивалентный объем VT, можно вычислить концентрацию пробы
и определив эквивалентный объем VT, можно вычислить концентрацию пробы 


