Примеры решения задач. Пример 1. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли после добавления к 1 л раствора 0,1 моль соляной
Пример 1. Вычислить изменение рН ацетатного буферного раствора, содержащего по 1 моль/л кислоты и соли после добавления к 1 л раствора 0,1 моль соляной кислоты. Решение. 1. вычислим рН данного буферного раствора по формуле (112)
2. После добавления к буферному раствору соляной кислоты концентрация ацетата натрия уменьшится, концентрация уксусной кислоты увеличится вследствие протекания реакции: CH3COONa + HCl ® CH3COOH + NaCl на величину 0,1 моль/л. 3. Вычислим рН нового раствора:
4. Найдем изменение рН: ΔрН = 4,75 - 4,66 = 0,09. Пример 2. К 0,8 л 0,5 М раствора НСООН (Kd = 1,8×10-4) добавили 0,2 л 0,4 М раствора NaOH. Вычислить рН образовавшегося формиатного буфера и его буферную емкость по кислоте и щелочи. Решение. 1. Вычислим количество вещества НСООН и NaOH:
2. Объем буферного раствора V равен:
3. Определим количество вещества формиата натрия, образующегося по реакции NaOH+HCOOH®HCOONa+H2O:
Найдем молярную концентрацию формиата натрия в буферном растворе:
4. Найдем остаточное количество вещества муравьиной кислоты:
и ее молярную концентрацию в буферном растворе
5. Определим рН буферного раствора
6. Буферную емкость по кислоте определим при помощи уравнения (120):
Буферную емкость по щелочи определим при помощи уравнения (119):
Пример 3. Сколько граммов твердого формиата натрия HCOONa надо добавить к 100 мл 0,2 М раствора соляной кислоты, чтобы получить буферный раствор с рН = 4,3? Решение. 1. При добавлении к раствору соляной кислоты формиата натрия образуется муравьиная кислота по реакции: HCOONa + HCl ® HCOOH + NaCl, С (HCOOH) = С (HCl) = 0,2 моль/л. 2. Для образования формиатного буферного раствора необходима определенная концентрация формиата натрия, которую найдем исходя из формулы (114):
откуда 3. Определим количество вещества формиата натрия, необходимого для получения данного буферного раствора:
|





 моль.
моль. моль/л.
моль/л.
 моль/л.
моль/л.



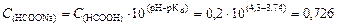 моль/л.
моль/л. моль и его массу
моль и его массу  г.
г.


