Примеры решения задач. Пример 1. Рассчитать растворимость флюорита CaF2 в воде, в 0,1 моль/л растворе NaF.
Пример 1. Рассчитать растворимость флюорита CaF2 в воде, в 0,1 моль/л растворе NaF. Решение. 1. Запишем уравнение диссоциации CaF2, отвечающее равновесному растворению флюорита: CaF2(т) ® Сa2+(p-p) + 2F-(p-p), согласно которому [Ca2+] = S; [F-] = 2 S. 2. Составим уравнение произведения растворимости CaF2: L = [Ca2+][F-]2 = S×(2 S)2 = 4 S 3, из которого вычислим растворимость флюорита в воде:
3. Для расчета растворимости в 0,1 М растворе NaF, которую обозначим S 1, произведем следующие подстановки в уравнение произведения растворимости: L = [Ca2+][F-]2; [Ca2+] = S 1; [F-] = 2 S 1 + C NaF = 0,1 моль/л, так как S 1<< 0,1. Получаем: L = S 1(0,1)2, откуда
Пример 2. Вычислить рН гидратообразования для раствора сульфата никеля с концентрацией 0,01 моль/л ( Решение. 1. Осадок гидроксида образуется из раствора NiSO4 в результате установления следующего равновесия: Ni(OH)2 ® Ni2+ + 2OH-. 2. Гидратообразование начинается при условии: [Ni2+]×[OH-]2 = L, откуда
рОН = -lg[OH-] = -lg1,09×10-7 = 6,96; рH = 14 - рОН = 7,04. Пример 3. Произойдет ли осаждение малорастворимого AgNO2 (L = 1,6×10-4) по реакции AgNO3 + KNO2 ® AgNO2 + KNO3 при смешивании равных объемов 0,02 М растворов AgNO3 и KNO2? Решение. 1. Для образования осадка AgNO2 должно выполняться условие [Ag+][NO2-] ≥ L. Проверим, выполняется ли это условие в нашей задаче. 2. После смешивания равных объемов растворов AgNO3 и KNO2 общий объем раствора будет в два раза больше каждого из исходных, и концентрации AgNO3 и KNO2 соответственно уменьшатся в два раза, т. е. будут равны 0,01 моль/л. [Ag+][NO2-] = 0,01×0,01 = 1×10-4 > L, следовательно, осадок образуется.
|

 моль/л.
моль/л. моль/л.
моль/л.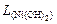 = 1,2×10-16).
= 1,2×10-16).



