Примеры решения задач. Пример 1. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II).
Пример 1. составить молекулярное и ионное уравнения гидролиза, указать характер среды для сульфата железа (II). Решение. 1. Напишем уравнение диссоциации соли: FeSO4 ® Fe2+ + SO42- 2. Определим сильный и слабый электролиты. Иону Fe2+ соответствует слабое основание Fe(OH)2, иону SO42- соответствует сильная кислота H2SO4, следовательно гидролиз идет по катиону. 3. Составим ионное уравнение гидролиза (по первой ступени!): Fe2+ + HOH ® FeOH+ + H+. В ходе гидролиза образуются ионы H+, среда кислая. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: 2 FeSO4 + 2H2O ® (FeOH)2SO4 + H2SO4. Пример 2. составить молекулярное и ионное уравнения гидролиза, указать характер среды для карбоната калия. Решение. 1. Напишем уравнение диссоциации соли: K2CO3 ® K+ + CO32- 2. Определим сильный и слабый электролиты. Иону K+ соответствует сильное основание KOH, иону CO32- соответствует слабая кислота H2CO3, следовательно гидролиз идет по аниону. 3. Составим ионное уравнение гидролиза (по первой ступени!): CO32-+ HOH ® HCO3-+ OH-. В ходе гидролиза образуются ионы OH-, среда в растворе щелочная. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: K2CO3 + H2O ® KHCO3+ KOH. Пример 3. составить молекулярное и ионное уравнения гидролиза, указать характер среды для нитрита аммония. Решение. 1. Напишем уравнение диссоциации соли: NH4NO2 ® NH4+ + NO2-. 2. Определим сильный и слабый электролит. Иону NH4+ соответствует слабое основание NH4OH, иону NO2- соответствует слабая кислота HNO2, следовательно гидролиз идет как по катиону так и по аниону. 3. Составим ионное уравнение гидролиза: NH4+ + NO2- + HOH ® NH4OH + HNO2. 4. Составим молекулярное уравнение гидролиза и уравняем его как обычную реакцию обмена: NH4NO2 + H2O ® NH4OH + HNO2. Пример 4. Вычислить рН раствора сульфата аммония, концентрацией 0,1 моль/л. Решение. 1. Составим ионное уравнение гидролиза: NH4+ + H2O ® NH4OH + H+. 2. Значение константы диссоциации гидроксида аммония Kd = 1,76×10-5. Вычислим константу гидролиза:
3. Найдем концентрацию ионов аммония. Согласно уравнению диссоциации сульфата аммония (NH4)2SO4 ® 2 NH4+ + SO42-,
4. Вычислим концентрацию ионов [H+]:
и значение рН: рН = -lg[H+] = -lg(1,066×10-5) = 4,97. Пример 5. вычислить степень гидролиза карбоната натрия в растворе с рН = 12. Решение. 1. Составим ионное уравнение гидролиза: CO32- + H2O ® HCO3- + OH-. 2. Значение второй константы диссоциации угольной кислоты Kd 2 = 4,69×10-11. Вычислим первую константу гидролиза:
3. Из формулы где [OH-] = 10-pOH = 10-(14-12) = 10-2 4. Вычислим степень гидролиза
|

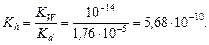

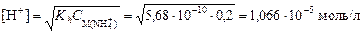
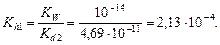
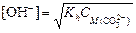 найдем концентрацию карбонат-иона:
найдем концентрацию карбонат-иона: 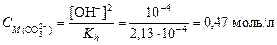 ,
,



