Равновесия в буферных растворах
Буферными называют растворы, способные поддерживать определенное значение рН при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Буферное действие основано на связывании добавляемых ионов Н + или ОН - в молекулы малодиссоциированных соединений. Различают следующие типы буферных растворов. 1. Смесь слабой кислоты и ее соли, например, СН3СООН + NaCH3COO (уксусная кислота + ацетат натрия). При добавлении сильной кислоты к этому раствору анионы соли связывают ионы Н + в молекулы малодиссоциированной уксусной кислоты:
При добавлении щелочи протекает реакция нейтрализации:
где p Kd – показатель константы диссоциации слабой кислоты, p Kd = –lg Kd; С с и С к – концентрации соли и килоты соответственно, моль/л 2. Смесь средней и кислой соли или двух кислых солей слабой многоосновной кислоты, например, Na2CO3 + NaHCO3 или Na2HPO4 + NaH2PO4. Анионы кислой соли реагируют подобно слабой кислоте в п.1.
где С с и С к – концентрации кислой и средней соли соответственно, моль/л 3. Кислые соли слабых многоосновных кислот, при добавлении к растворам которых сильных кислот или щелочей протекают аналогичные реакции:
где p Kn – показатель контснты диссоциации кислоты по соответствующей ступени. 4. Смесь слабого основания и его соли, например, NH4OH + NH4Cl. Буферное действие основано на реакциях:
где p Kd – показатель константы диссоциации слабого основания; С с и С осн – концентрации соли и основания соответственно, моль/л 5. Соли слабых кислот и слабых оснований, например, NH4CH3COO. Буферное действие обусловлено реакциями:
Емкостью буферного раствора В называют количество сильной кислоты или щелочи, которое требуется добавить к 1 л раствора для изменения его рН на единицу. Раствор утрачивает буферные свойства при добавлении сильной кислоты или щелочи в количестве, превышающем буферную емкость. Различают буферную емкость раствора по кислоте и по щелочи. Емкость кислого буфера по щелочи, В Щ.
При решении уравнения получаем:
емкости кислого буфера по кислоте:
Отсюда получаем формулу для расчета
Емкости основного буфера по кислоте и по щелочи:
Выбор состава буферного раствора. Отношение С с/ С к или С с/ С осн выбирают в пределах 0,1< С соли/ С к-ты <10. По таблицам констант диссоциации подбирают слабую кислоту с p Kd = pH±1(или слабое основание с p Kd = pOH ±1), исходя из заданного рНвычисляют отношение концентраций С с / С к (или С с / С осн).
|

 ,
,
 ,
,
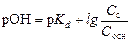 ,
,
 .
.
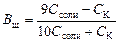 .
.
 .
.
 .
.
 .
.
 .
.



