Равновесие в системе осадок – раствор
Таблица 6. Произведения растворимости
Произведение растворимости – одна из основных характеристик осадка, численное значение которой необходимо для решения многих химико-аналитических задач:
1) расчёт растворимости осадков при заданных условиях:
- в воде (через ПР0 при μ → 0 или через ПР при μ > 0);
- в присутствии одноимённых ионов (через ПР0 при μ → 0 или через ПР при μ > 0);
- в присутствии разноимённых ионов (через ПР);
2) расчёт условий растворения и осаждения осадков:
- условий количественного осаждения малорастворимого соединения (см. Пример 4);
- условий начала образования осадка;
- условий, при которых осадок не выпадает;
3) прогнозирование возможности выпадения осадка при смешении растворов заданной концентрации (путём сравнения ПР0 и ПС);
4) выбор осадителя и осаждаемой формы для конкретного иона (см. Пример 5);
5) оценка возможности обнаружения или количественного определения конкретного иона с использованием реакций осаждения (см. Пример 6).
При решении некоторых из этих задач используются следующие условия, требования и количественные критерии.
| Ø Осадок выпадает при условии ПС ³ ПР0.
Ø Осадок растворяется при условии ПС < ПР0.
Ø Осаждение считается количественным, если остаточная концентрация осаждаемого иона в растворе не превышает 10–6 моль/л.
Ø Осадитель должен образовывать с определяемым ионом как можно менее растворимое соединение.
Ø В качестве осаждаемой формы пригодны только те осадки, для которых ПР0 £ 10–8 (для бинарных электролитов).
| l Пример 4. При какой концентрации фторид-ионов магний (II) количественно осадится в виде MgF2?
Равновесие
MgF2¯ «Mg2+ + 2F–
характеризуется табличной величиной произведения растворимости:
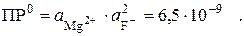
Поскольку в насыщенном растворе малорастворимого электролита μ → 0, то активности можно заменить на концентрации. После подстановки [Mg2+] = 10–6 моль/л получим:

l Пример 5. Выбрать осаждаемую форму и осадитель для гравиметрического определения алюминия (III).
Из приведённых в таблице осадков, содержащих ион алюминия (III), наименее растворимым является Al(OH)3, следовательно, он является подходящей гравиметрической формой, а в качестве осадителя можно использовать щёлочи либо гидроксид аммония. Однако в избытке щелочей амфотерный гидроксид Al(OH)3 растворяется, поэтому осаждение надо проводить раствором NH4OH.
l Пример 6. Можно ли использовать реакцию образования MgC2O4 для количественного определения магния (II) с использованием гравиметрического или перманганатометрического методов
анализа?
По значению ПР0 = 8,6·10–5 можно сделать вывод, что осадок MgC2O4 в заметной степени растворим, следовательно, он не может служить осаждаемой формой в гравиметрическом методе анализа и не позволит с достаточной точностью провести титриметрическое определение.
Таблица 6
Произведения растворимости важнейших
малорастворимых веществ
| Формула вещества
| ПР
| |
|
| | Ag3AsO3
| 1∙10–17
| | Формула вещества
| ПР
| |
|
| | Ag3АsО4
| 1∙10–22
|
|
|
| | AgBO2
| 4∙10–3
| | AgBr
| 5,3∙10–13
| | AgBrO3
| 5,5∙10–5
| | AgC2H3O2
| 4∙10–3
| | AgCN
| 1,4∙10–16
| | Ag2CO3
| 1,2∙l0–12
| | Ag2C2O4
| 3,5∙10–11
| | AgCl
| 1,78∙10–10
| | AgClO2
| 2∙10–4
| | AgClO3
| 5,0∙10–2
| | Ag2CrO4
| 1,1∙10–12
| | Ag2Cr2O7
| 1∙10–10
| | Ag3Fe(CN)6
| 1∙10–22
| | Ag4Fe(CN)6
| 8,5∙10–45
| | Ag2HVO4
| 2∙10–14
| | AgI
| 8,3·10–17
| | AgIO3
| 3,0·10–8
| | AgMnO4
| 1,6·10–3
| | Ag2MoO4
| 2,8·10–9
| | AgN3
| 2,9·10–9
| | AgNO2
| 6,0·10–4
| | Ag2O (Ag+,OH–)
| 1,95·10–8
| | AgOCN
| 2,3·10–7
| | Ag3PO4
| 1,3·10–20
| | AgReO4
| 7,95·10–5
| | Ag2S
| 6,3·10–50
| | AgSCN
| 1,1·10–12
| | Ag2SO3
| 1,5·10–14
| | AgSO3NH2
| 1·10–1
| Продолжение табл. 6
|
|
| | Ag2SO4
| 1,6·10–5
| | AgSeCN
| 4,0·10–16
| | Ag2SeO3
| 9,8·10–16
| | Ag2SeO4
| 5,6·10–8
| | AgVO3
| 5·10–7
| | Ag2WO4
| 5,5·10–12
| | AlAsO4
| 1,6·10–16
| | А1(ОН)3
| 3,2·10–34
| | A1PO4
| 5,75·10–19
| | Ba3(AsO4)2
| 7,8·10–51
| | Ba(BrO3)2
| 5,5·10–6
| | BaCO3
| 4,0·10–10
| | BaC2O4
| 1,1·10–7
| | BaCrO4
| 1,2·10–10
| | BaF2
| 1,1·10–6
| | Ba2Fe(CN)6
| 3·10–8
| | Ba(IO3)2
| 1,5·10–9
| | BaMnO4
| 2,5·10–10
| | BaMoO4
| 4·10–8
| | Ba3(PO4)2
| 6·10–39
| | Ba2P2O7
| 3∙10–11
| | BaSO3
| 8∙10–7
| | BaSO4
| 1,1∙10–10
| | BaS2O3
| 1,6∙10–5
| | BaSeO4
| 5∙10–8
| | BeCO3
| 1∙10–3
| | BeMoO4
| 3,2∙10–12
| | Be(OH)2
| 4,9∙10–22
| | BiAsO4
| 2,8∙10–10
|
|
|
| | BiI3
| 8,1∙10–19
| | Bi(OH)3
| 3,2∙10–32
| | BiPO4
| 1,3∙10–23
| | Bi2S3
| 1∙10–97
| | Ca3(AsO4)2
| 6,8∙10–19
| | CaC4H4O6 (тартрат)
| 7,7∙10–7
| | CaCO3
| 3,8∙10–9
| | CaC2O4
| 2,3∙10–9
| | CaCrO4
| 7,1∙10–4
| | CaF2
| 4,0∙10–11
| | Ca(NH4)2Fe(CN)6
| 4∙10–8
| | Са(IO3)2
| 7,0∙10–7
| | Ca(OH)2
| 6,5∙10–6
| | Ca3(PO4)2
| 2,0∙10–29
| | CaPO3F (Ca2+, PO3F2–)
| 4∙10–3
| | CaSO3
| 3,2∙10–7
| | CaSO4
| 2,5∙10–5
| | CaSeO3
| 4,7∙10–6
| | CaSiF6
| 8,1∙10–4
| | CaWO4
| 9,0∙10–9
| | Cd3(AsO4)2
| 2,2∙10–33
| | Cd(CN)2
| 1,0∙10–8
| | CdCO3
| 1,0∙10–12
| | CdC2O4
| 1,5∙10–8
| | Cd2Fe(CN)6
| 4,2∙10–18
| | Cd(OH)2
| 5,9∙10–15
| | CdS
| 1,6·10–28
| | CdSeO3
| 5,0·10–9
| | Ce(IO3)4
| 5·10–17
| Продолжение табл. 6
|
|
| | Ce(OH)3
| 1,5·10–20
| | CoCO3
| 1,05·10–10
| | CoC2O4
| 6,3·10–8
| | Co2Fe(CN)6
| 4,8·10–38
| | Co(IO3)2
| 1,0·10–4
| | Co(OH)2
| 2,0·10–16
| | Co(OH)3
| 4·10–45
| | CoS α
| 4,0·10–21
| | CoS β
| 2,0·10–25
| | CoSeO3
| 1,6·10–7
| | CrAsO4
| 7,8·10–21
| | Cr(OH)2
| 1,0·10–17
| | Cr(OH)3
| 6,3·10–31
| | CrPO4
| 2,4·10–23
| | CsClO4
| 4∙10–3
| | Cu3(AsO4)2
| 7,6∙10–36
| | CuBr
| 5,25∙10–9
| | CuCN
| 3,2∙10–20
| | CuCO3
| 2,5∙10–10
| | CuC2O4
| 3∙10–9
| | CuCl
| 1,2∙10–6
| | CuCrO4
| 3,6∙10–6
| | Cu2Fe(CN)6
| 1,3∙10–16
| | CuI
| 1,1∙10–12
| | Сu(IO3)2
| 7,4∙10–8
| | CuN3
| 5,0∙10–9
| | Cu2O (2Cu+, OH–)
| 1∙10–14
| | Cu(OH)2
| 8,3∙10–20
| | Cu2(OH)2CO3
| 1,7∙10–34
|
|
|
| | Cu2P2O7
| 8,3∙10–16
| | CuS
| 6,3∙10–36
| | Cu2S
| 2,5∙10–48
| | CuSCN
| 4,8∙10–15
| | CuSe
| 1∙10–49
| | CuSeO3
| 1,7∙10–8
| | FeAsO4
| 5,8∙10–21
| | FeCO3
| 3,5∙10–11
| | FeC2O4
| 2∙10–7
| | Fe4[Fe(CN)6]3
| 3,0∙10–41
| | Fe(OH)2
| 7,1∙10–16
| | Fe(OH)3
| 6,3∙10–38
| | FePO4
| 1,3∙10–22
| | FeS
| 5∙10–18
| | HgS
| 1,6∙10–52
| | In(OH)3
| 1,2∙10–37
| | In2S3
| 5,75∙10–74
| | K3AlF6
| 1,6∙10–9
| | K(C6H5)4B
| 2,25∙10–8
| | K3Co(NO2)6
| 4,3∙10–10
| | K2PdCl6
| 6,0∙10–6
| | K2PtCl6
| 1,1∙10–5
| | La2S3
| 2,0∙10–13
| | Li3PO4
| 3,2∙10–9
| | Mg3(AsO4)2
| 2,1∙10–20
| | MgCO3
| 2,1∙10–5
| | MgC2O4
| 8,6∙10–5
| | MgF2
| 6,5∙10–9
| | Mg(IO3)2
| 3∙10–3
| Продолжение табл. 6
|
|
| | MgK2Fe(CN)6
| 5∙10–9
| | Mg(NH4)2Fe(CN)6
| 4∙10–8
| | MgNH4PO4
| 2,5∙10–13
| | Mg(OH)2
| 7,1∙10–12
| | Mg3(PO4)2
| 1∙10–13
| | MgSO3
| 3∙10–3
| | MgSeO3
| 4,4∙10–6
| | Mn3(AsO4)2
| 1,9∙10–29
| | MnCO3
| 1,8∙10–11
| | MnC2O4
| 5∙10–6
| | Mn2Fe(CN)6
| 7,9∙10–13
| | MnNH4PO4
| 1∙10–12
| | Mn(OH)2
| 1,9∙10–13
| | Mn(OH)3
| 1∙10–36
| | MnS
| 2,5∙10–10
| | MnSeO3
| 5,4∙10–8
| | (NH4)3AlF6
| 1,6∙10–3
| | (NH4)3Co(NO2)6
| 7,6∙10–6
| | (NH4)2IrCl6
| 3∙10–5
| | (NH4)2PtCl6
| 9∙10–6
| | Na3AlF6
| 4,1∙10–10
| | NaSb(OH)6
| 4∙10–8
| | Na2SiF6
| 2,8∙10–4
| | Ni3(AsO4)2
| 3,1∙10–26
| | Ni(CN)2
| 3∙10–23
| | NiCO3
| 1,3∙10–7
| | NiC2O4
| 4∙10–10
| | Ni(ClO3)2
| 1∙10–4
| | Ni2Fe(CN)6
| 1,3∙10–15
|
|
|
| | Ni(IO3)2
| 1,4∙10–8
| | Ni(OH)2
| 2,0∙10–15
| | Ni2P2O7
| l,7∙10–13
| | NiS
| 3,2∙10–19
| | NiSeO3
| 1,0∙10–5
| | Pb3(AsO4)2
| 4,1∙10–36
| | PbBr2
| 9,1∙10–6
| | Pb(BrO3)2
| 8,0∙10–6
| | PbCO3
| 7,5∙10–14
| | PbC2O4
| 4,8∙10–10
| | РbС12
| 1,6∙10–5
| | РbСrO4
| 1,8∙10–14
| | PbF2
| 2,7∙10–8
| | Pb2Fe(CN)6
| 9,55∙10–19
| | PbI2
| 1,1∙10–9
| | Рb(IO3)2
| 2,6∙10–13
| | РbМоO4
| 4,0∙10–6
| | Pb(N3)2
| 2,6∙10–9
| | Рb(ОН)2
| 7,9∙10–16
| | Рb3(РО4)2
| 7,9∙10–43
| | PbS
| 2,5∙10–27
| | Pb(SCN)2
| 2,0∙10–5
| | PbSO4
| 1,6∙10–8
| | PbS2O3
| 4,0∙10–7
| | PbSe
| 1∙10–38
| | PbSeO3
| 3∙10–12
| | PbSeO4
| 1,45∙10–7
| | PbWO4
| 4,5∙10–7
| | Pb(OH)4
| 3,0∙10–66
| Окончание табл. 6
|
|
| | Sc(OH)3
| 5,0∙10–37
| | SnI2
| 8,3∙10–6
| | Sn(OH)2
| 6,3∙10–27
| | Sn(OH)4
| 1∙10–57
| | SnS
| 2,5∙10–27
| | Sr3(AsO4)2
| 1,3∙10–18
| | SrCO3
| 1,1∙10–10
| | SrC2O4
| 1,6∙10–7
| | SrCrO4
| 3,6∙10–5
| | SrF2
| 2,5∙10–9
| | Sr(IO3)2
| 3,3∙10–7
| | SrMoO4
| 2∙10–7
| | Sr(OH)2
| 3,2∙10–4
| | Sr3(PO4)2
| 1∙10–31
| | SrSO3
| 4∙10–8
| | SrSO4
| 3,2∙10–7
| | SrSeO3
| 4,4∙10–6
| | Y(OH)3
| 6,3∙10–25
| | Zn3(AsO4)2
| 1,3∙10–28
| | Zn(CN)2
| 2,6∙10–13
| | ZnCO3
| 1,45∙10–11
| | ZnC2O4
| 2,75∙10–8
| | Zn2Fe(CN)6
| 2,1∙10–16
| | Zn(IO3)2
| 2,0∙10–8
| | Zn(OH)2
| 1,4∙10–17
| | Zn3(PO4)2
| 9,1∙10–33
| | ZnS
| 1,6∙10–24
| | ZnSe
| 1∙10–31
| | ZnSeO3
| 1,9∙10–8
| Таблица 7. Значения рН осаждения гидроксидов металлов
Значения рН начала осаждения гидроксидов металлов, практически полного их осаждения, а также начала растворения и полного растворения осадков амфотерных гидроксидов необходимы во всех случаях выбора оптимального интервала значений рН с целью обнаружения, разделения и количественного определения ионов многовалентных металлов.
l Пример 7. В какой среде можно оттитровать комплексонометрически ион Fe3+ при его концентрации в растворе ~ 0,01 моль/л?
Поскольку гидроксид железа (III) из 0,01 М раствора начинает осаждаться при рН = 2,3, то титрование можно провести только в кислой среде.
l Пример 8. Можно ли разделить ионы Cr3+ и Mg2+ при их концентрациях 0,01 моль/л, регулируя значение рН раствора?
Cr(OH)3 практически полностью осаждается при рН = 6,8, а начинает растворяться при рН = 9,4. Mg(OH)2 начинает осаждаться при рН = 10,4, полнота осаждения его достигается при рН = 12,4. Следовательно, в интервале 6,8 < рН < 9,4 ион Cr3+ будет находиться в осадке, а ион Mg2+ – в растворе, т. е. разделение возможно.
Таблица 7

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|

Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности...
|
ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ИНЪЕКЦИЙ К лекарственным формам для инъекций относятся водные, спиртовые и масляные растворы, суспензии, эмульсии, новогаленовые препараты, жидкие органопрепараты и жидкие экстракты, а также порошки и таблетки для имплантации...
Тема 5. Организационная структура управления гостиницей 1. Виды организационно – управленческих структур. 2. Организационно – управленческая структура современного ТГК...
Методы прогнозирования национальной экономики, их особенности, классификация В настоящее время по оценке специалистов насчитывается свыше 150 различных методов прогнозирования, но на практике, в качестве основных используется около 20 методов...
|
Субъективные признаки контрабанды огнестрельного оружия или его основных частей
Переходя к рассмотрению субъективной стороны контрабанды, остановимся на теоретическом понятии субъективной стороны состава преступления...
ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКОЙ ПОМОЩИ НАСЕЛЕНИЮ В УСЛОВИЯХ ОМС 001. Основными путями развития поликлинической помощи взрослому населению в новых экономических условиях являются все...
МЕТОДИКА ИЗУЧЕНИЯ МОРФЕМНОГО СОСТАВА СЛОВА В НАЧАЛЬНЫХ КЛАССАХ В практике речевого общения широко известен следующий факт: как взрослые...
|
|