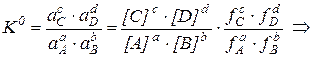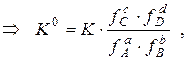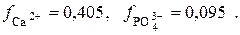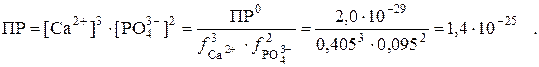Введение. Мы предоставляет широкий спектр услуг в области пошива
«Ника»
Мы предоставляет широкий спектр услуг в области пошива. В нашем ателье можно изготовить одежду любых видов:
Также, к нам можно обратится, если требуется ремонт и реставрация одежды и других швейных изделий:
Наше оборудование позволяет профессионально работать со многими материалами:
ЦЕРКОВНОЕ ОБЛАЧЕНИЕ Важное направление нашей швейной мастерской это изготовление всех видов церковной утвари, необходимой для украшения православного храма, облачений священнослужителей. Работы выполняются по индивидуальным меркам, на высоком техническом уровне.
и многое другое: жилеты, крестильные рубашки, платы.. Пошив изделий как из материалов заказчика, так и мастерской.
Аналитическая химия. Справочные материалы
Учебно-методическое пособие по дисциплинам «Аналитическая химия» И «Аналитическая химия и физико-химические методы анализа» для студентов Химико-технологических специальностей
Минск 2005 УДК 543(076)(083.5) ББК Ф Рассмотрены и рекомендованы к изданию редакционно-издательским советом университета.
Составители: А.Е. Соколовский, Е.В. Радион Под общей редакцией канд. хим. наук, доцента Е.В. Радион
Рецензенты Профессор кафедры аналитической химии БГУ, доктор химических наук А.Л.Гулевич; доцент кафедры физической и коллоидной химии, канд. хим. наук Л.Я.Крисько
Аналитическая химия.Справочные материалы:Учебно-методическое пособие по дисциплинам «Аналитическая химия» и «Аналитическая химия и физико-химические методы анализа» для студентовхимико-технологических специальностей. / сост. А.Е.Соколовский,Е.В.Радион; под общ. ред. Е.В.Радион – Мн.: БГТУ, 2005. 80 с.
ISBN 985-434-463-0
УДК 543(076)(083.5) ББК Ф
© УО«Белорусский государственный ISBN 985-434-463-0 технологический университет», 2005 Введение Аналитическая химия, являясь фундаментальной наукой, имеет большое практическое значение в жизни общества, поскольку создает средства для химического анализа и обеспечивает его осуществление. Химико-аналитические расчеты базируются на относительно небольшом количестве формул и правил и огромном массиве физико-химических констант и справочных данных. Издания, в которых содержались бы формулы, условия и критерии, с одной стороны, и справочные величины – с другой, прак-тически отсутствуют. Поэтому в настоящем пособии справочные материалы приведены именно в таком сочетании, что окажет Вам помощь при выполнении всех видов расчётов и выборе оптимальных условий проведения анализа с целью ответа на практические вопросы и выполнения зачётных экспериментальных работ. Пособие включает пять разделов в соответствии с программой лабораторного практикума по химическим методам анализа. Внутри разделов справочные материалы сгруппированы в последовательности их использования при изучении курса. Каждую таблицу предваряют краткие сведения о том, каким образом используются данные конкретного вида для решения химико-аналити-ческих задач.
l Маркером выделены примеры решения расчётных и практических задач. При подготовке таблиц использованы следующие справочные издания: 1) Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1989. – 448 с. 2) Справочник химика-аналитика / Лазарев А.И., Харламов И.П., Яковлев П.Я., Яковлева Е.Ф. – М.: Металлургия, 1976. – 184 с. 3) Дорохова Е.Н., Прохорова Г.В. Задачи и вопросы по аналитической химии. – М.: Мир, 2001. – 267 с. 4) Коренман Я.И., Суханов П.Т., Калинкина С.П. Задачник по аналитической химии. Титриметрические методы анализа. – Воронеж: ВГТА, 2001. – 336 с. Общие вопросы Общие вопросы теории растворов Таблица 1. Коэффициенты активности различных ионов Коэффициенты активности ионов используют во всех случаях, когда требуется перейти от термодинамической константы равновесия К 0 (табличная величина, выражается через активности исходных веществ и продуктов реакции) к реальной константе К (выражается через равновесные концентрации). Для обратимой химической реакции aA + bB ↔ cC + dD соотношение между термодинамической и реальной константами равновесия имеет вид:
где а – активности веществ; f – коэффициенты активности. l Пример 1. В насыщенном растворе малорастворимой соли Ca3(PO4)2 устанавливается равновесие между осадком и раствором: Ca3(PO4)2↓ ↔ 3Ca2+ + 2PO43–, которое описывается константой – произведением растворимости. В табл. 6 приведено термодинамическое значение ПР0 = 2,0·10–29. Оно пригодно для расчёта растворимости соли, если ионная сила μ = 0. Для расчёта растворимости в присутствии постороннего сильного электролита необходимо воспользоваться реальной константой (ПР), которая вычисляется на основании табличных величин – значения ПР0 и значений коэффициентов активности ионов осадка при данной ионной силе. В табл. 1 находим значения коэффициентов активности ионов кальция (II) и фосфат-ионов при μ = 0,1:
«В достаточно разбавленных растворах с одинаковой ионной силой коэффициенты активности большинства одинаково заряженных ионов приблизительно одинаковы». Таблица 1
|