Стандартные электродные потенциалы (Е°) при 25°С
| Элемент
| Полуреакция
| Eo,В
| |
|
|
| | Ag
| Ag+ + e = Ag↓
| +0,7994
| | AgBr↓ + e = Ag↓ + Br–
| +0,071
| | AgCl↓ + e = Ag↓ + Cl–
| +0,222
| | AgI↓ + e = Ag↓ + I–
| –0,152
| | As
| H3AsO4 + 2H+ + 2 е = HAsO2 + 2H2O
| +0,56
| 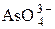 + 2H2O + 2 е = + 2H2O + 2 е =  + 4ОН– + 4ОН–
| –0,71
| | Br
| Br2 + 2 e = 2Br–
| +1,087
| 2 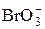 + 12H+ + 10 e = Br2↓ + 6H2O + 12H+ + 10 e = Br2↓ + 6H2O
| +1,52
| 2 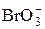 +6H2O + 10 e = Br2↓ + 12OH– +6H2O + 10 e = Br2↓ + 12OH–
| +0,50
| | C
| CO2↑ + 2H+ + 2 e = HCOOH
| –0,20
| | 2CO2↑ + 2H+ + 2 e = H2C2O4
| –0,49
| | Са
| Са2+ + 2 e = Ca↓
| –2,79
| | Cd
| Cd2+ + 2 e = Cd↓
| –0,403
| | Се
| Се4+ + e = Ce3+
| +1,77
| | Сl
| Сl2↑ + 2 e = 2C1–
| +1,359
| | 2HOС1 + 2Н+ + 2 e = Cl2↑+H20
| +1,63
| | 2C1O–+2H2O + 2 e = С12↑ +4OH–
| +0,40
| | HC1O + H+ + 2 e = Сl– + Н2О
| +1,50
| Продолжение табл. 14
|
|
|
| | Cl
| ClO– + H2O + 2 e = Сl– + 2OН–
| +0,88
| | НСlO2+2H+ + 2 e = HClO + H2O
| +1,64
| | 2HClO2 + 6H+ + 6 e = Cl2↑+4H2O
| +1,63
| | HClO2 + 3H+ + 4 e = Cl– + 2H2O
| + 1,56
| 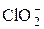 + H2O + 2 e = ClO– + 2OН– + H2O + 2 e = ClO– + 2OН–
| +0,66
| 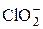 + 2H2О + 4e = C1– + 4OH– + 2H2О + 4e = C1– + 4OH–
| +0,77
|  +3Н+ + 2 e = HC1O2 + H2O +3Н+ + 2 e = HC1O2 + H2O
| +1,21
|  + H2O + 2e = + H2O + 2e = 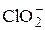 + 2OH– + 2OH–
| +0,33
|  + 2H+ +e = C1O2↑ + H2O + 2H+ +e = C1O2↑ + H2O
| +1,15
|  + 6H+ +6 e = Cl– + 3H2O + 6H+ +6 e = Cl– + 3H2O
| +1,45
|  + 3H2O+6 e = Сl– + 6OН– + 3H2O+6 e = Сl– + 6OН–
| +0,63
|  + 2H+ + 2 e = + 2H+ + 2 e =  + Н2О + Н2О
| +1,19
|  +H2O+2 e = +H2O+2 e =  + 2OH– + 2OH–
| +0,36
| 2  + 16H++ 14 e = С12↑ +8Н2О + 16H++ 14 e = С12↑ +8Н2О
| +1,39
|  + 8H+ + 8 e = Сl– + 4Н2О + 8H+ + 8 e = Сl– + 4Н2О
| +1,38
|  + 4H2O + 8 e = С1– + 8OН– + 4H2O + 8 e = С1– + 8OН–
| +0,56
| | Со
| Со3+ + e = Со2+
| +1,95
| | Со2+ + 2 e = Со↓
| –0,29
| 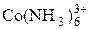 + e = + e = 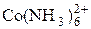
| +0,1
| | Cr
| Cr3+ + e = Сr2+
| –0,41
| | Сr3+ + 3 e = Сr↓
| –0,74
| 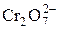 + 14Н+ + 6 e = 2Сr3+ + 7Н2О + 14Н+ + 6 e = 2Сr3+ + 7Н2О
| +1,33
| 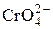 + 4Н2О + 3 e = Сr(ОН)3↓+5ОН– + 4Н2О + 3 e = Сr(ОН)3↓+5ОН–
| –0,13
| | Сu
| Cu2+ + 2 e = Сu↓
| +0,345
| | Cu+ + e = Сu↓
| +0,531
| Продолжение табл. 14
|
|
|
| | Сu
| Cu2+ + e = Сu+
| +0,159
| | F
| F2↑ + 2 е = 2F–
| +2,77
| | Fe
| Fe3+ + е = Fe2+
| +0,771
| | Fe3+ + 3 e = Fe↓
| – 0,058
| | Fe2+ + 2 е = Fe↓
| – 0,473
| 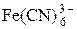 + e = + e = 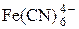
| +0,364
| | Ga
| Ga3+ + 3 e = Ga↓
| – 0,56
| | H
| 2H+ + 2 е =H2↑
| 0,0000
| | 2H2O + 2 е = H2↑ +2OH–
| –0,828
| | H2O2 + 2H+ + 2 е = 2H2O
| +1,77
| 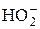 + H2O + 2 e = 3ОH– + H2O + 2 e = 3ОH–
| +0,88
| | Hg
| 2Hg2+ + 2 е = 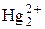
| +0,907
| | Hg2+ + 2 е = Hg↓
| +0,850
| 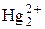 + 2 е = Hg↓ + 2 е = Hg↓
| +0,792
| | I
| I2↓ + 2 е = 2I–
| +0,536
| | I2 + 2 е = 2I–
| +0,621
|  + 2 е =3I– + 2 е =3I–
| +0,545
| | 2IBr + 2 е = I2↓ + 2Br–
| +1,02
| | ICN↑ + 2 е = I– + CN–
| +0,30
| | 2ICN↑ + 2H+ + 2 е =I2↓ +2HCN
| +0,63
| | 2ICl↑ + 2 е = I2↓ + 2Cl–
| +1,19
| | 2НIО + 2Н+ + 2 е = I2↓+2H2O
| +1,45
| | 2IO– + H2O + 2 е = I2↓ + 4OH–
| +0,45
| | HIO + H+ + 2 е = I– + H2O
| +0,99
| | IO– + H2O+2 е = I– + 2OH–
| +0,49
| Продолжение табл. 14
|
|
|
| |
| 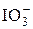 + 5H++ 4 е = HIO + 2H2O + 5H++ 4 е = HIO + 2H2O
| +1,14
| 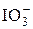 +2H2O + 4 е = IO– + 4OH– +2H2O + 4 е = IO– + 4OH–
| +0,14
| 2 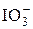 + 12H+ + 10 e = I2↓ + 6H2O + 12H+ + 10 e = I2↓ + 6H2O
| +1,19
| 2 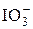 +6H2O + 10 e = I2↓ + 12OH– +6H2O + 10 e = I2↓ + 12OH–
| +0,21
| 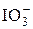 + 6H+ + 6 е = I– + 3H2O + 6H+ + 6 е = I– + 3H2O
| +1,08
| 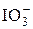 + 3H2O + 6 е = I– + 6OH– + 3H2O + 6 е = I– + 6OH–
| +0,26
| H5IO6 + H+ + 2 е = 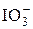 + 3H2O + 3H2O
| ≈+1,6
| 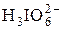 + 2 е = + 2 е = 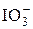 + 3OН– + 3OН–
| ≈+0,7
| | H5IO6 + 7H+ + 8 е = I– + 6Н2О
| ≈+1,24
| 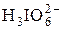 + 3H2O + 8е = I– + 9OН– + 3H2O + 8е = I– + 9OН–
| ≈+0,37
| | In
| In3+ + 3 е =In↓
| –0,34
| | Ir
| Ir3+ + 3 е = Ir↓
| ≈+1,15
| | К
| K++ e = К↓
| –2,923
| | La
| La3+ + 3 е = La↓
| –2,52
| | Li
| Li+ + е = Li↓
| –3,04
| | Mg
| Mg2+ + 2 е = Mg↓
| –2,37
| | Мn
| Мn3+ + е = Мn2+
| +1,51
| | Мn2+ + 2е = Мn↓
| –1,17
| | Mn(OH)3↓ + e = Мn(ОН)2↓ + OH–
| +0,1
| | MnO2↓ + 4H+ + 2 е = Мn2++2Н2О
| +1,23
| 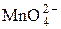 + 2H2O + 2 е =MnO2↓ + 4OH– + 2H2O + 2 е =MnO2↓ + 4OH–
| +0,58
|  +е = +е = 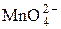
| +0,558
|  + 4H++3 е = MnO2↓ + 2H2O + 4H++3 е = MnO2↓ + 2H2O
| +1,69
|  + 2H2O + 3 e = MnO2↓ + 4OH– + 2H2O + 3 e = MnO2↓ + 4OH–
| +0,60
|  + 8H+ + 5 е = Mn2+ + 4H2O + 8H+ + 5 е = Mn2+ + 4H2O
| +1,51
| Продолжение табл. 14
|
|
|
| | Мо
| Мо3+ + 3 е = Mo↓
| –0,2
| 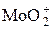 + 4H++2 e = Mo3+ + 2H2O + 4H++2 e = Mo3+ + 2H2O
| 0,0
| 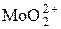 +e = +e = 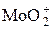
| +0,48
| | H2MoO4 + 6H+ + 6е = Mo↓ + 4H2O
| 0,0
| 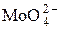 + 4Н2О + 6 е = Mo↓ + 8OH– + 4Н2О + 6 е = Mo↓ + 8OH–
| –1,05
| | N
| HN3 + 11H+ + 8 e = 3 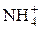
| +0,69
| | 3N2↑ + 2H+ + 2 е = 2HN3
| –3,1
| 3N2↑ + 2 е = 2 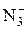
| –3,4
| | N2↑ + 2H2O + 4H+ + 2 е = 2(NH2OH·H+)
| –1,87
| | N2↑ + 4H2O + 2 е = 2NH2OH+ 2OH–
| –3,04
| | N2↑ + 5H+ + 4 е = N2H4·H+
| –0,23
| | N2↑ + 4H2O + 4 е = N2H4 + 4OH–
| –1,16
| N2↑ + 8H+ + 6 е = 2 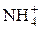
| +0,26
| | N2↑ + 8H2O + 6 е = 2NH4OH+ 6OH–
| –0,74
| N2H4·H+ + 3H+ + 2 е = 2 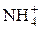
| +1,27
| | N2H4 + 4H2O + 2 е = 2NH4OH+ 2OH–
| +0,1
| NH2OH·H++2H+ + 2 е = 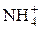 + H2O + H2O
| +1,35
| | NH2OH + 2H2O + 2 е = NH4OH + 2OH–
| +0,42
| | H2N2O2 + 2H+ + 2 е = N2↑ +2H2O
| +2,65
| | H2N2O2 + 6H+ + 4 е = 2(NH2OH·H+)
| +0,50
| | 2HNO2+ 4H+ + 4 e = H2N2O2 + 2H2O
| +0,83
| | HNO2 + H+ +е = NO↑ + H2O
| +0,98
|  + H2O + е = NO↑+ 2OH– + H2O + е = NO↑+ 2OH–
| –0,46
| | 2HNO2 + 4H+ + 4 e = N2O↑ + 3H2O
| +1,29
| | 2HNO2 + 6H+ + 4 e =N2↑ + 4H2O
| +1,44
| Продолжение табл. 14
|
|
|
| | N
| 2  + 4H2O + 6 е = N2↑ + 8OH– + 4H2O + 6 е = N2↑ + 8OH–
| +0,41
| HNO2 + 7H+ + 6 е = 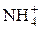 + 2H2O + 2H2O
| +0,86
|  + 6H2O + 6 е = NH4OH + 7OH– + 6H2O + 6 е = NH4OH + 7OH–
| –0,15
| | N2O↑ + 2H+ + 2 е = N2↑ + H2O
| +1,77
| | N2O↑ + H2O + 2 е = N2↑ + +2OH–
| +0,94
| | 2NO↑ +4H+ + 4 e = N2↑ + 2H2O
| +1,68
| | 2NO↑ +2H2O + 4 e = N2↑ + 4OH–
| +0,85
| | N2O4↑ + 2H+ + 2 е = 2HNO2
| +1,07
| N2O4↑ + 2 е = 2 
| +0,88
| | N2O4↑ + 8H++8е = N2↑ + 4H2O
| +1,35
| | N2O4↑ + 4H2O + 8 е = N2↑+8OH–
| +0,53
| 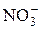 + 3H+ + 2 е = HNO2 + H2O + 3H+ + 2 е = HNO2 + H2O
| +0,94
| 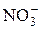 + H2O + 2 е = + H2O + 2 е =  + 2OH– + 2OH–
| +0,01
| 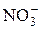 + 2H+ + е = NO2↑ + H2O + 2H+ + е = NO2↑ + H2O
| +0,80
| 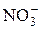 + H2O + e = NO2↑ +2OH– + H2O + e = NO2↑ +2OH–
| –0,86
| 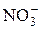 + 4H+ + 3 е = NO↑ + 2H2O + 4H+ + 3 е = NO↑ + 2H2O
| +0,96
| 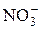 + 2H2O + 3 е = NO↑ + 4OH– + 2H2O + 3 е = NO↑ + 4OH–
| –0,14
| 2 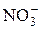 + 12H+ + 10 e = N2↑+6H2O + 12H+ + 10 e = N2↑+6H2O
| +1,24
| 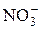 + 8H+ + 6 е = NH2OH·H+ + 2H2O + 8H+ + 6 е = NH2OH·H+ + 2H2O
| +0,73
| 2 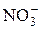 + 17H++ 14 е = N2H4·H+ + 6H2O + 17H++ 14 е = N2H4·H+ + 6H2O
| +0,84
| 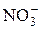 + 10H+ + 8 е = + 10H+ + 8 е = 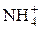 + 3H2O + 3H2O
| +0,87
| 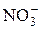 + 7H2O + 8 е = NH4OH +9OH– + 7H2O + 8 е = NH4OH +9OH–
| –0,12
| | Na
| Na+ + e = Na↓
| –2,713
| | Nb
| Nb3+ + 3 е = Nb↓
| –1,1
| | Ni
| Ni2+ + 2 е = Ni↓
| –0,228
| Продолжение табл. 14
|
|
|
| | O
| O2↑ + 4H+ + 4 e = 2H2O
| + 1,229
| | O2↑ + 2H2O + 4 e = 4OH–
| +0,401
| | O2↑ + 2H+ + 2 е = H2O2
| +0,682
| O2↑ + H2O + 2е = 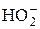 + OH– + OH–
| –0,076
| | H2O2 + 2H+ + 2 е = 2H2O
| +1,77
| 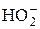 + H2O + 2 е = 3OH– + H2O + 2 е = 3OH–
| +0,88
| | O3↑ + 2H+ + 2 е = O2↑ + H2O
| +2,07
| | O3↑ + H2O + 2 е = O2↑ + 2OH–
| +0,02
| | Os
| Os2+ + 2 е = Os↓
| +0,85
| | OsO4↓ + 8H+ + 8 е = Os↓ + 4H2O
| +0,85
| | P
| P↓ + 3H+ + 3 e = PH3↑
| +0,06
| | P↓ + 3H2O + 3 e = PH3↑+3OH–
| –0,89
| | H3PO2 + H + + е = P↓ +2H2O
| –0,51
|  + е = P↓ + 2OH– + е = P↓ + 2OH–
| –2,05
| | H3PO3 + 3H+ + 3 е = P↓ + 3H2O
| –0,50
| | H3PO3+ 2H+ + 2 е = H3PO2 + H2O
| –0,50
|  + 2Н2O + 2 е = + 2Н2O + 2 е =  + 3OH– + 3OH–
| –1,57
| | H4P2O6 + 2H+ + 2 е = 2H3PO3
| +0,38
| | H3PO4 + 5H+ + 5 е = P↓+4H2O
| –0,41
| | H3PO4 + 4H+ + 4 е = H3PO2 + 2H2O
| –0,39
| | 2H3PO4 + 2H+ + 2 е = H4P2O6 + 2H2O
| –0,94
| | H3PO4 + 2H+ + 2 е = H3PO3 + H2O
| –0,276
| 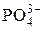 + 2H2O + 2 е = + 2H2O + 2 е =  + 3ОН– + 3ОН–
| –1,12
| | Рb
| Рb2+ + 2 е = Pb↓
| –0,126
| | Pb4+ + 2 е = Рb2+
| +1,66
| Продолжение табл. 14
|
|
|
| | Pb
| Pb4+ + 4 е = Pb↓
| +0,77
| | PbO2↓ + H2O + 2 е = PbO↓ + 2OН–
| +0,28
| | PbO2↓ + 4H+ + 2 е = Рb2+ + 2H2O
| +1,455
| | Pd
| Pd2+ + 2 е = Pd↓
| +0,915
| | Pt
| Pt2+ + 2е = Pt↓
| +1,2
| | S
| S↓ + 2 е = S2–
| –0,476
| | S↓ + 2H+ + 2 е = H2S↑
| +0,171
| | (SCN)2↑ + 2 е = 2SCN–
| +0,77
| 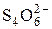 + 2 е = 2 + 2 е = 2 
| +0,09
|  + 6H+ + 4 e = 2S↓+3Н2О + 6H+ + 4 e = 2S↓+3Н2О
| +0,5
| 2Н2SО3 + 2Н+ + 4 e =  + 3H2O + 3H2O
| +0,40
| 2  + 3H2O + 4 e = + 3H2O + 4 e =  + 6OH– + 6OH–
| –0,58
| 2H2SO3+H+ + 2 е = 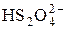 + 2Н2О + 2Н2О
| –0,08
| 2  + 2H2O + 2 е = + 2H2O + 2 е =  + 4OH– + 4OH–
| –1,12
|  + 4H+ + 2 е = H2SO3 + H2O + 4H+ + 2 е = H2SO3 + H2O
| +0,17
|  +H2O + 2 е = +H2O + 2 е =  + 2OH– + 2OH–
| –0,93
| 2  + 10H+ + 8 e = + 10H+ + 8 e =  + 5Н2О + 5Н2О
| +0,29
| 2  + 5H2O + 8 е = + 5H2O + 8 е =  + 10OH– + 10OH–
| –0,76
|  + 8H+ + 6 е = S↓ + 4H2O + 8H+ + 6 е = S↓ + 4H2O
| +0,36
|  + 4H2O + 6 е = S↓ + 8OH– + 4H2O + 6 е = S↓ + 8OH–
| –0,75
| 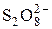 + 2 e = 2 + 2 e = 2 
| +2,01
| | Sb
| SbО+ + 2Н+ + 3 е = Sb↓+H2O
| +0,212
| | Sc
| Sc3+ + 3 е = Sc↓
| –2,08
| | Se
|  + H2O + 2 е = + H2O + 2 е = 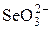 + 2OH– + 2OH–
| +0,05
| | Si
| 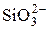 + 3H2O + 4 е = Si↓ + 6OH– + 3H2O + 4 е = Si↓ + 6OH–
| –1,7
| Продолжение табл. 14
|
|
|
| | Sn
| Sn2+ + 2 е = Sn↓
| –0,140
| | Sn4+ + 2 е = Sn2+
| +0,15
| | Sn4+ + 4е =Sn↓
| +0,01
| | Sr
| Sr2+ + 2 е = Sr↓
| –2,89
| | Te
| 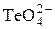 + H2O + 2 e = + H2O + 2 e =  + 2OH– + 2OH–
| +0,4
| | Th
| Th4+ + 4 е = Th↓
| –1,90
| | Ti
| Ti2+ + 2е = Тi↓
| –1,63
| | TiO2↓ + 4H+ + 4 е = Ti↓ + 2H2O
| –0,86
| | TiO2+ + 2H+ + 4 e = Ti↓ + H2O
| –0,88
| | TiO2+ + 2H+ + е = Ti3+ + H2O
| +0,1
| | Ti3+ + е = Ti2+
| –0,37
| | Tl
| Tl+ + е= Tl↓
| –0,357
| | Тl3+ + 2 е = Tl+
| +1,25
| | U
| U3+ + 3 е = U↓
| –1,80
| | U4+ + е = U3+
| –0,61
|  + 4H+ + 2 е =U4+ + 2H2O + 4H+ + 2 е =U4+ + 2H2O
| +0,33
| | V
| V2+ + 2 е = V↓
| –1,18
| | V3+ + е = V2+
| –0,255
| | VO2+ + 2H++ e =V3+ + H2O
| +0,337
| | VO2+ + e = VO+
| –0,044
| 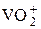 + 2H+ + е = VO2+ + H2O + 2H+ + е = VO2+ + H2O
| +1,000
| 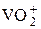 + 4H+ + 2 е = V3++ 2H2O + 4H+ + 2 е = V3++ 2H2O
| +0,668
| 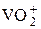 +4H+ + 3 е = V2++2H2O +4H+ + 3 е = V2++2H2O
| +0,360
| 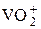 + 4H+ + 5 е = V↓ + 2H2O + 4H+ + 5 е = V↓ + 2H2O
| –0,25
|  + 6H+ + 2 е =VO+ + 3H2O + 6H+ + 2 е =VO+ + 3H2O
| +1,26
| Окончание табл. 14
|
|
|
| |
| 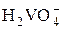 + 4H+ +е = VO2+ + 3H2O + 4H+ +е = VO2+ + 3H2O
| +1,31
| | W
| 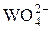 + 8H+ + 6 е = W↓ + 4H2O + 8H+ + 6 е = W↓ + 4H2O
| +0,05
| | Y
| Y3+ + 3 е = Y↓
| –2,37
| | Zn
| Zn2+ + 2 е = Zn↓
| –0,764
| | Zn(OH)2 + 2e = Zn↓ + 2OH–
| –1,245
| 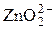 + 2H2O = Zn + 4OH– + 2H2O = Zn + 4OH–
| –1,216
| | Zr
| ZrO2↓ + 4H+ + 4 e = Zr↓ + 2H2O
| –1,43
|

Аальтернативная стоимость. Кривая производственных возможностей В экономике Буридании есть 100 ед. труда с производительностью 4 м ткани или 2 кг мяса...
|

Вычисление основной дактилоскопической формулы Вычислением основной дактоформулы обычно занимается следователь. Для этого все десять пальцев разбиваются на пять пар...
|

Расчетные и графические задания Равновесный объем - это объем, определяемый равенством спроса и предложения...
|

Кардиналистский и ординалистский подходы Кардиналистский (количественный подход) к анализу полезности основан на представлении о возможности измерения различных благ в условных единицах полезности...
|
Шов первичный, первично отсроченный, вторичный (показания) В зависимости от времени и условий наложения выделяют швы:
1) первичные...
Предпосылки, условия и движущие силы психического развития Предпосылки –это факторы. Факторы психического развития –это ведущие детерминанты развития чел. К ним относят: среду...
Анализ микросреды предприятия Анализ микросреды направлен на анализ состояния тех составляющих внешней среды, с которыми предприятие находится в непосредственном взаимодействии...
|
Сущность, виды и функции маркетинга персонала Перснал-маркетинг является новым понятием. В мировой практике маркетинга и управления персоналом он выделился в отдельное направление лишь в начале 90-х гг.XX века...
Разработка товарной и ценовой стратегии фирмы на российском рынке хлебопродуктов В начале 1994 г. английская фирма МОНО совместно с бельгийской ПЮРАТОС приняла решение о начале совместного проекта на российском рынке. Эти фирмы ведут деятельность в сопредельных сферах производства хлебопродуктов.
МОНО – крупнейший в Великобритании...
ОПРЕДЕЛЕНИЕ ЦЕНТРА ТЯЖЕСТИ ПЛОСКОЙ ФИГУРЫ Сила, с которой тело притягивается к Земле, называется силой тяжести...
|
|