Прегнин
Praegninum. Aethisteronum. Прегнин. 17-α-этинилтестостерон. Δ4-17-этиниландростен-3-он-17-ол. С21Н28О2. М = 312,46
Прегнин — белый или слегка желтоватый кристаллический порошок без запаха, т. пл. 268—274°, не растворим в воде, мало растворим в спирте и ацетоне, хлороформе и в пиридине. С гидрохлоридом гидроксиламина в присутствии ацетата натрия в среде метилового спирта образует оксим, который, после перекристаллизации из 70%-ного метилового спирта, плавится при 226—232°. Раствор в концентрированной серной кислоте при разбавлении водой и прибавлении хлороформа окрашивает последний в красный цвет. Чистоту препарата определяют по отсутствию примесей (сульфатная зола не должна превышать 0,1%, а потеря в весе при высушивании до постоянного веса при 100° —0,5%). Хранят с предосторожностью (список Б), в хорошо закупоренных банках, в сухом месте, защищенном от действия света. Высшая разовая доза — 0,015 г, суточная —0,05 г. Применяют по 2 таблетки (по 5 мг) 3 раза в день; он в 5—6 раз менее активен, нежели прогестерон. Особенностью прегнина является его свойство сохранять активность и оказывать терапевтическое действие при приеме внутрь, особенно сублингвально. При гидрировании двойной связи прегнина или замене карбонильной группы гидроксильной активность утрачивается, но при расширении пятичленного цикла D до шестичленного — D-гомопрогестерон обнаруживает почти такую же активность, как и прогестерон. Синтез D-гомопрогестерона представляет собой точное повторение синтеза прогестерона из 3-ацетата Дегидроэпиандростерона-17. При действии на последний (I) синильной кислоты получен оксинитрил (II), который восстановлением литийалюминийгидридом превращен в оксиамин (III) и при обработке азотистой кислотой в гомодегидроэпиандростерон (IV). С помощью реакции Оппенауэра и др. (IV) Превращается в D-гомопрогестерон (V):
Превращение III в IV под влиянием азотистой кислоты является известной перегруппировкой Демьянова. Не только замена пятичленного цикла на шестичленный, но и удаление С19-метильной группы не изменяет гормональных свойств; активность молекулы повышается и 19-норпрогестерон (VI) в 7—8 раз активнее прогестерона. При синтезе 19-норпрогестерона исходят из метилового эфира эстрона (VII) и боковую цепь образуют аналогично предыдущему. Действием реактива Гриньяра на нитрил (VIII), образующийся в результате дегидратации оксинитрила (II), получают после гидрирования кетон (IX). При восстановлении ароматического кольца (Л) литием в жидком аммиаке восстанавливается и карбонильная группа (IX), но гидролиз образовавшегося винилового эфира (X) приводит к α,β-непредельному кетону (XI), который при окислении хромовым ангидридом переходит в 19-норпрогестерон (VI):
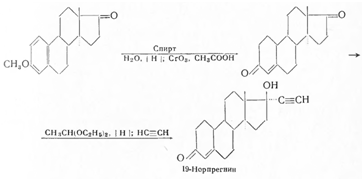
Исходя из метилового эфира эстрона, был получен по нижеприведенной схеме 19-норпрегнин (норлутин), оказавшийся в 3—4 раза активнее прегнина с транс-сочленением колец В/С и С/D:
В 1957 г. Эренштейн в США получил 19-норпрогестерон с цис-сочленением колец С/D и α-положением боковой цепи (-СОСН3) строения:
Его активность оказалась в 8 раз выше активности прогестерона. Этот факт заслуживает внимания, так как ранее принималось, что стероиды с цис-сочленением колец С/D являются неактивными. Для получения 19-норпрогестерона ацетат строфантидина (I) окислялся перманганатом калия в щелочной среде и образовавшаяся за счет «лактонного» кольца с одной стороны и альдегидной группы с другой кетокислота (II) самопроизвольно замыкалась в лактон (III). При обработке последнего перекисью водорода, в присутствии щелочи, боковая цепь окислялась до карбоксильной группы, причем под влиянием щелочи происходила инверсия у С17, в результате чего получилась кислота (IV). При действии хлористого водорода на (IV) наступала дегидратация с образованием V, а при последующем гидрировании получалась кислота с цис-сочленением колец С и D (VI). При нагревании до 200° удалялись ангулярные — ОН группа при С14 и СООН — группа при С10 и образовывалась непредельная при Q—С10 ацетоксикислота (VII). Действием оксалилхлорида на (VII) получался хлорангидрид (VIII), который с диметилкадмием превращался в оксикетон (IX) и затем по Оппенауэру в 19-норпрогестерон (X):
Из аналогов прегнина, содержащего при С6 и С21 метильные группы, следует отметить полученный В. Петровым (Англия). Действием ацетиленида лития в жидком аммиаке на 3-ацетат дегидроэпиандростерона-17 (I) синтезирован 3,17-диол (II), гидроксильные группы которого защищались дигидропираном и дигидропиранилдиол (III) обрабатывался последовательно бутиллитием и йодистым метилом, что после гидролиза привело к пропинилдиолу (IV). Окислением диола (IV) по Оппенауэру синтезирован соответствующий кетон (V) и из него этиленкеталь (VI). При действии на кеталь (VI) надфталевой кислоты получена соответствующая окись (VII), которая с магнийбромметилом, с разрывом окисного кольца, превращена в гликоль (VIII). Кислым гидролизом гликоль (VIII) превращен в кетодиол (IX) и действием едкого натра в пиридине — в кетон (X). При действии на кетон (X) хлористого водорода образуется эпимер, переходящий в α-метилпроизводное (XI), оказавшееся в 12 раз активнее прегнина:
|