Кортизон-ацетат
Cortisonum aceticum. Cortisoni acetas. Кортизон-ацетат. 11-дегидро-17-α-оксикортикостерон-21-ацетат Δ4-прегнендиол-17α,21-трион-3,11,20,21-ацетат. С23н30о6. М = 402,5.
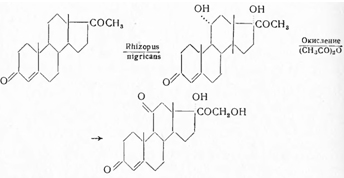
Синонимы: Аdreson, Соrtisуl, Соrtоnе. Описаны многочисленные методы синтеза; из них практический интерес имеют лишь те, которые приводят к значительным выходам. Всего целесообразнее исходить из прогестерона, который с помощью микробиологического окисления превращают в 11-оксипрогестерон и затем окислением в кортизон:
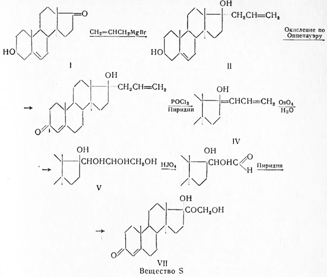
Петерсоном с сотрудниками (1953) было показано, что для синтеза кортизона целесообразно использование вещества S Рейхштейна (I), которое при окислении превращают в 11-эпигидрокортизон (II); при окислении ацетата последнего образуется кортизон (III):
Вещество S Рейхштейна не получило медицинского применения, но оказалось важным для синтеза кортизона. Еще в 1937 г. автором было показано, что оно может быть синтезировано из дегидроэпиандростерона по схеме: Как следует из схемы, необычным является образование диена (IV), который возникает в результате дегидратации (II), и перегруппировка (V) в (VI), под влиянием пиридина, открытая еще в 90-х годах Лобри-де-Брюином на примере глицеринового альдегида, изомерирующегося в диоксиацетон.
Синтез кортизона осуществлен также по методу Н.Н. Суворова из прогестерона (I) с применением микробиологических реакций. С помощью плесневого грибка Rhizopus nigricans [I] окисляют до И ос-оксипрогестерона (II) и двойную связь при С4 гидрируют в присутствии палладия, осажденного на кальции карбонате, при обычных условиях в среде пиридина до образования прегнанол-11α-диона-3,20 (III). Последний подвергают окислению бихроматом калия в присутствии серной кислоты и образовавшийся прегнантрион-3,11,20 (IV) вновь восстанавливают в пиридиновом растворе боргидридом натрия. При выливании в охлажденную разбавленную соляную кислоту выделяется прегнанол-3α-дион-11,20 (V). С целью получения прегнандиол-3α,17α-диона-11,20 (VIII), прегнанол-3α-дион-11,20 (V) подвергают кипячению с уксусным ангидридом и получают енолацетат (VI), который окисляют надфталевой кислотой. Образовавшуюся окись (VII) гидролизуют 1%-ным водно-метанольным раствором едкого натра и продукт реакции - прегнандиол-3α,17α-дион-11,20 (VIII) извлекают хлороформом. Бромирование (VIII) производят диоксандибромидом, в результате чего получают 21-бромпрегнан-диол-3α,17α-дион-11,20 (IX). Окисление производят бромсукцинимидом в метаноле при обычной температуре; при этом образуется 21-бромпрегнанол-17α-трион-3,11,20 (X). Для получения ацетата дигидрокортизона (XI) 21-бромпрегнанол-17α-трион-3,11,20 нагревают в диметилформамиде с безводным ацетатом натрия и продукт реакции высаживают водой. Бромирование ацетата дигидрокортизона (XI) производят диоксандибромидом в диметилформамиде в присутствии катализатора п-толуолсульфокислоты и полученный бромид (XII) высаживают водой. Превращение бромида (XII) в семикарбазон кортизон-ацетата (XIII) производят обработкой семикарбазидом в смеси хлороформа и третичнобутилового спирта. При растворении последнего в уксусной кислоте и действии пировиноградной кислоты происходит пересемикарбазирование и образуется кортизон-ацетат (XIV):
Кортизон-ацетат — белый или белый с желтоватым оттенком порошок, т. пл. 235—245° (с разл.), не растворим в воде, мало растворим в спирте и в ацетоне, растворяется в хлороформе, вращает плоскость поляризации вправо. Удельный показатель поглощения 390±10 (с = 0,001, 95% спирт) при 238 ммк. При нагревании до 70° метанольного раствора препарата с раствором фенилгидразинсульфата возникает желтая окраска, а при щелочном гидролизе спиртовым раствором едкого кали и прибавлении серной кислоты ощущается запах этилацетата. Раствор препарата в концентрированной серной кислоте обнаруживает желтую флуоресценцию, которую лучше наблюдать при нанесении на белую фарфоровую пластинку (отличие от преднизона).
Чистоту препарата определяют по отсутствию галогена (проба Бейльштейна), потере в весе (не более 0,5% при высушивании до постоянного веса при 100—105°), золы, семикарбазона кортизонацетата (минерализованный концентрированной серной кислотой в присутствии пергидрола препарат с реактивом Несслера в щелочной среде не должен обнаруживать более интенсивной окраски, нежели эталон на аммиак, приготовленный с теми же реактивами по ГФ). Кортизон-ацетат количественно может быть определен по оптической плотности при реакции с антроном в концентрированной серной кислоте. Кортизон-ацетат растворяют в абсолютном спирте (примерно 1 мг в 1 мл), часть раствора доводят до объема в 2 мл абсолютным спиртом, прибавляют 2 мл реактива (0,2%-ный раствор анилина в 96%-ной серной кислоте) и спустя 1 ч оптическую плотность определяют при 480 ммк спектрофотометром. Хранят с предосторожностью (список Б), в стеклянных, хорошо закупоренных банках, в защищенном от света месте. Высшая разовая доза — 0,15 г, суточная —0,3 г. Применяют внутрь и внутримышечно при ревматизме, подагрических, инфекционных и псориатических артритах, бронхиальной астме, острых лейкозах и других заболеваниях. Детям кортизон назначают внутримышечно, начиная с 0,05 г 2 раза в день. Выпускают в порошках, таблетках по 0,025 и 0,05 г, флаконах по 5 и 10 мл суспензии, содержащей 25 мг в 1 мл.
|