Задачи для самостоятельного решения. 2.1. Определить среднюю кинетическую энергию <W> одной молекулы водяного пара при температуре T = 400 К.
2.1. Определить среднюю кинетическую энергию <W> одной молекулы водяного пара при температуре T = 400 К. 2.2. Определить среднюю квадратичную скорость 2.3. Водород находится при температуре T = 300 К. Найти среднюю кинетическую энергию 2.4. При какой температуре средняя кинетическая энергия 2.5. В азоте взвешены мельчайшие пылинки массой 6∙10 2.6. Определите давление, оказываемое газом на стенки сосуда, если его плотность равна 0,01 кг/м3, а средняя квадратичная скорость молекул газа составляет 480 м/с. 2.7.Азот массой m = 10 г находится при температуре Т = 290 К. Определите: 1) среднюю кинетическую энергию одной молекулы азота; 2) среднюю кинетическую энергию вращательного движения всех молекул газа. Газ считать идеальным. 2.8. Средняя квадратичная скорость молекул некоторого газа равна 450 м/с2. Давление газа р = 50 кПа. Найти плотность газа при этих условиях. 2.9. Плотность некоторого газа r = 0,082 кг/м3 при давлении р = 100 кПа и температуре t = 17°С. Найти среднюю квадратичную скорость молекул газа. Какова молярная масса этого газа? 2.10. Во сколько раз средняя квадратичная скорость пылинки, взвешенной в воздухе, меньше средней квадратичной скорости молекул воздуха? Масса пылинки 5∙10-8 г. Воздух считать однородным газом, молярная масса которого 29 г/моль. 2.11. В баллоне объемом V = 15 л находится аргон под давлением 2.12. Вычислить плотность r азота, находящегося в баллоне под давлением р = 1,4 МПа при температуре T = 300 К. 2.13. Определить относительную молекулярную массу Mr газа, если при температуре T = 154 К и давлении p = 2,8 МПа он имеет плотность r = 6,1 кг/м3. 2.14. В сосуде объемом V = 40 л находится кислород. Температура кислорода Т = 300 К. Когда часть кислорода израсходовали, давление в баллоне понизилось на Dр = 100 кПа. Определить массу m израсходованного кислорода, если температура газа в баллоне осталась прежней. 2.15. Смесь водорода и азота общей массой m = 290 г при температуре T = 600 К и давлении p =2,46 МПа занимает объем V = 40 л. Определить массу 2.17. Смесь состоит из водорода с массовой долей 2.19. Смесь кислорода и азота находится в сосуде под давлением p=1,2 МПа. Определить парциальные давления 2.20. Углекислый газ в количестве v = 1 кмоль, занимает объем 0,5 м3 при температуре 100°С. Найти давление газа считая его реальным. Постоянные Ван-дер-Ваальса для углекислого газа равны a = 0,364 Па×м6/моль2 и b= 4,26×10-5 м3/моль. 2.21. Какая часть молекул кислорода при температуре t = 5°С обладает скоростями v от 100 до 120 м/с? 2.22. Какая часть молекул азота при температуре t = 1 50°С обладает скоростями v от 300 до 345 м/с? 2.23. Какая часть молекул азота при температуре Т имеет скорости, лежащие в интервале от vВ до vВ + Dv, где Dv = 20 м/с если: 1) Т = 400 К, 2) Т = 900К? 2.24. Какая часть молекул водорода при температуре t = 1 50°С имеет скорости, лежащие в интервале от v1 = 300 м/с до v2 = 700 м/с? 2.25. Обсерватория располагается на высоте h = 3250м над уровнем моря. Найти давление воздуха на этой высоте. Температуру воздуха считать постоянной и равной t = 5°С. Давление воздуха на уровне моря р0 = 101,3 кПа. Молярная масса воздуха М = 29 г/моль. 2.26. На какой высоте h над уровнем моря давление воздуха составляет 80% от давления на уровне моря. Температуру воздуха считать постоянной и равной t = 0°С. 2.27.Найти плотность воздуха: 1) у поверхности Земли; 2) на высоте h = 4км от поверхности Земли. Температуру воздуха считать постоянной и равной t = 0°С. Давление воздуха у поверхности Земли р0 = 101 кПа. 2.28. Пылинки массой m = 10-18 г взвешены в воздухе. Определить, во сколько раз уменьшится концентрация пылинок при увеличении высоты на 10 м? Считать, что температура во всех слоях воздуха одинаковая и равна Т = 300 К. 2.29. На сколько раз уменьшится атмосферное давление р = 100 кПа при подъеме наблюдателя над поверхностью Земли на высоту: 1) 100 м; 2) 1000 м? Считать, что температура воздуха с высотой не меняется и равна Т = 290 К. 2.30. Барометр в кабине летящего вертолета показывает давление р = 90 кПа. На какой высоте h летит вертолет, если на взлетной площадке барометр показывал давление р0 = 101 кПа? Считать, что температура воздуха с высотой не меняется и равна Т = 290 К. 2.31. Кислород массой m = 200 г занимает объем V1 = 100 л и находится под давлением p1 =200 кПа. При нагревании газ расширился при постоянном давлении до объема V2 = 300 л, а затем его давление возросло до p3 = 500 кПа при неизменном объеме. Найти изменение внутренней энергии DU газа и совершенную им работу А. 2.32. Объем водорода при изотермическом расширении увеличился в n = 4 раза. Определить работу А, совершенную газом, и теплоту Q, полученную им при этом. Масса m водорода равна 100 г. 2.33. Азот массой m = 0,1 кг был изобарически нагрет от температуры T1 = 200 К до температуры T2 = 400 К. Определить работу A, совершенную газом, полученную им теплоту Q и изменение 2.34. Во сколько раз увеличится объем водорода, содержащий количество вещества 2.35. В баллоне при температуре Т1 = 145 К и давлении р1 = 2МПa находится кислород. Определить температуру Т2 и давление р2 кислорода после того, как из баллона будет очень быстро выпущена половина газа. 2.36. При изобарическом расширении двухатомного газа была совершена работа А = 156,8 Дж. Какое количество теплоты было сообщено газу? 2.37. Количество n = 1,5 кмоль углекислого газа нагревается при постоянном давлении на 60К. Найти изменение внутренней энергии газа и работу расширения газа. 2.38. В закрытом сосуде находится масса m1 = 28г азота и масса m2 =32 г кислорода. Найти изменение внутренней энергии смеси газов при ее охлаждении на 30 К. 2.39. Азот массой m = 280 г расширяется в результате изобарного процесса при давлении р = 1 МПа. Определите: 1) работу расширения; 2) конечный объем газа, если на расширение затрачена теплота Q = 5 кДж, а начальная температура азота Т1 = 290 К. 2.40. Азот массой m = 14 г сжимают изотермически при температуре Т = 300 К от давления р1 = 100 кПа до давления р2 = 500 кПа. Определите: 1)изменение внутренней энергии газа; 2) работу сжатия; 3) количество выделившейся теплоты. 2.41. Найти удельные 2.42. Вычислить удельные теплоемкости газа, зная, что его молярная масса 2.43. Одноатомный газ при нормальных условиях занимает объем V = 5 л. Вычислить теплоемкость 2.44. Определить удельные теплоемкости 2.45. В сосуде находится смесь двух газов – кислорода массой 2.46. Смесь двух газов состоит из гелия массой 2.47. Найти молярные теплоемкости 2.48. Во сколько раз молярная теплоемкость гремучего газа больше молярной теплоемкости водяного пара, получившегося при его сгорании? Процесс – изохорный. 2.49. В сосуде объемом V = 6 л находится при нормальных условиях двухатомный газ. Определить теплоемкость 2.50.Определить молярные теплоемкости газа, если его удельные теплоемкости 2.51.Азот массой m = 20 г, имевший температуру T = 300 К, адиабатически расширился, увеличив объем в 2.52.Кислород массой m = 250 г, имевший температуру Т1 = 200 К, был адиабатически сжат. При этом была совершена работа A = 25 кДж. Определить конечную температуру Т газа. 2.53. Кислород массой m = 10 г, находящийся при норомальных условиях, адиабатически сжат до объема V2 = 1,5 л. Найти давление р2 и температуру Т2 кислорода после сжатия. 2.54. Относительная молекулярная масса газа 2.55. Какая часть молекул двухатомного газа распалась на атомы, если показатель адиабаты 2.56. При адиабатическом сжатии количества v = 1,5 кмоль двухатомного газа была совершена работа А = 186 кДж. На сколько увеличилась температура газа при сжатии? 2.57.Газ расширяется адиабатически, причем его объем увеличивается вдвое, а температура падает в 1,32 раза. Какое число степеней свободы i имеют молекулы этого газа? 2.58. Необходимо сжать воздух от объема V1 = 16 л до объема V2 = 5 л. Как выгоднее его сжимать (адиабатически, или изотермически)? 2.59. В сосуде под поршнем находится гремучий газ, занимающий при нормальных условиях объем V1 = 0,1 л. При быстром сжатии газ воспламеняется. Найти температуру воспламенения гремучего газа, если известно, что работа сжатия А = 46,35 Дж. 2.60. Двухатомный газ, находящийся при давлении р1 = 2МПа и температуре t1 = 27°С, сжимается адиабатически от объема V1 до объема V2 = 0,5 V1. Найти температуру t2 и давление p2 газа после сжатия. 2.61. Найти изменение DS энтропии при изотермическом расширении массы m = 10 г водорода от давления р1 = 100 кПа до давления р2 = 50 кПа. 2.62. Масса m = 5 г кислорода изотермически расширяется от объема V1 = 2 л до V2 = 5л. Найти изменение DS энтропии при этом процессе. 2.63. Масса m = 5 г азота нагревается от температуры Т1 = 50°С до Т2 = 150°С. Найти изменение DS энтропии, если нагревание происходит: 1) изохорически; 2) изобарически. 2.64. При нагревании 1 кмоль двухатомного газа, его термодинамическая температура увеличилась в 1,5 раза. Найти изменение DS энтропии, если нагревание происходит: 1) изохорически; 2) изобарически. 2.65.Определить работу А2 изотермического сжатия газа, совершающего цикл Карно, КПД которого h = 0,4, если работа изотермического расширения равна А 1 = 8 Дж. 2.66. Газ, совершающий цикл Карно, отдал охладителю теплоту Q2 = 16 кДж. Определить температуру Т1 нагревателя, если при температуре охладителя Т2 = 280 К работа цикла A = 6 кДж. 2.67. Газ, являясь рабочим веществом в цикле Карно, получил от нагревателя теплоту Q1 = 4,38 кДж и совершил работу A = 2,4 кДж. Определить температуру нагревателя, если температура охладителя Т2 =273 К. 2.68. Во сколько раз увеличится коэффициент полезного действия 2.69. Газ, совершающий цикл Карно, получает теплоту Q1 = 84 кДж. Какую работу А совершает газ, если температура Т1 нагревателя в три раза выше температуры Т2 охладителя? 2.70.Совершая цикл Карно, газ получил от нагревателя теплоту Q1 = 500 Дж и совершил работу А = 100 Дж. Температура нагревателя Т1 = 400 К. Определить температуру Т2 охладителя. 2.71. Какую работу А надо совершить при выдувании мыльного пузыря, чтобы увеличить его объем от 2.72. Какая энергия Е выделится при слиянии двух капель ртути диаметром 2.73 Какую работу против сил поверхностного натяжения надо совершить, чтобы разделить сферическую каплю ртути радиусом R = 4 мм на две одинаковые капли? 2.74. Какую работу против сил поверхностного натяжения надо совершить, чтобы увеличить втрое объем мыльного пузыря радиусом R = 2 см? Поверхностное натяжение мыльного раствора a = 0,043 Н/м. 2.75.Пространство между двумя стеклянными параллельными пластинками с площадью поверхности S = 100 см2 каждая, расположенными на расстоянии L = 15 мкм друг от друга, заполнено водой. Определить силу F, прижимающую пластинки друг к другу. Считать мениск вогнутым с диаметром d, равным расстоянию между пластинками. 2.76. Глицерин поднялся в капиллярной трубке диаметром канала d = 1 мм на высоту h = 20 мм. Определить коэффициент поверхностного натяжения 2.77. Найти разность уровней Dh ртути в двух сообщающихся капиллярах, внутренние диаметры которых равны d1=1 мм d2 = 2мм. Несмачивание считать полным. 2.78. Каким должен быть внутренний диаметр капилляра, чтобы при полном смачивании вода в нем поднималась на высоту h = 2,5 см? Задачу решить в двух случаях: 1) капилляр находится на Земле; 2) капилляр находится на Луне. Ускорение свободного падения на Луне принять равным 1,65 м/с2. 2.79. Капилляр внутренним радиусом r = 2 мм опущен в жидклсть. Найти поверхностное натяжение жидкости, если известно, что в капилляр поднялась масса жидкости m = 0,09 г 2.80.Каким должен быть наибольший диаметр пор в фитиле керосинки, чтобы керосин поднимался от дна керосинки до горелки (высота h = 10 см)? Считать поры цилиндрическими трубками и смачивание полным.
|

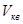 молекулы газа, заключенного в сосуде объемом V = 2 л под давлением p = 200 кПа. Масса газа m = 0,3 г.
молекулы газа, заключенного в сосуде объемом V = 2 л под давлением p = 200 кПа. Масса газа m = 0,3 г. вращательного движения одной молекулы, а также суммарную кинетическую энергию Eк всех молекул этого газа, если количество вещества водорода
вращательного движения одной молекулы, а также суммарную кинетическую энергию Eк всех молекул этого газа, если количество вещества водорода  = 0,5 моль.
= 0,5 моль. поступательного движения молекулы газа равна 4,14
поступательного движения молекулы газа равна 4,14  Дж?
Дж? г. каждая пылинки равна Газ находится при температуре T = 400 К. Определить средние квадратичные скорости vкв, а также средние кинетические энергии поступательного движения
г. каждая пылинки равна Газ находится при температуре T = 400 К. Определить средние квадратичные скорости vкв, а также средние кинетические энергии поступательного движения  молекулы азота и пылинки.
молекулы азота и пылинки. =600 кПа и температуре
=600 кПа и температуре  = 300 К. Когда из баллона было взято некоторое количество аргона, давление в баллоне понизилось до
= 300 К. Когда из баллона было взято некоторое количество аргона, давление в баллоне понизилось до  =400 кПа, а температура установилась
=400 кПа, а температура установилась  =260 К. Определить массу m аргона, взятого из баллона.
=260 К. Определить массу m аргона, взятого из баллона.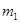 водорода и массу
водорода и массу 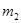 азота.
азота. =l/9 и кислорода с массовой долей
=l/9 и кислорода с массовой долей  =8/9. Найти плотность
=8/9. Найти плотность  такой смеси газов при температуре T=300 К и давлении p=0,2 МПа.
такой смеси газов при температуре T=300 К и давлении p=0,2 МПа. кислорода в смеси равна 20 %.
кислорода в смеси равна 20 %. внутренней энергии азота.
внутренней энергии азота.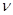 = 0,4 моль при изотермическом расширении, если при этом газ получит теплоту Q = 800 Дж? Температура водорода Т = 300К.
= 0,4 моль при изотермическом расширении, если при этом газ получит теплоту Q = 800 Дж? Температура водорода Т = 300К. и
и  и молярные
и молярные  и
и 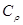 теплоемкости азота и гелия.
теплоемкости азота и гелия. =4∙10-3 кг/мoль и отношение теплоемкостей
=4∙10-3 кг/мoль и отношение теплоемкостей  и
и  такой смеси.
такой смеси. этой смеси.
этой смеси. = 4 раза. Затем при изотермическом сжатии объем газа уменьшился в
= 4 раза. Затем при изотермическом сжатии объем газа уменьшился в  = 2 раза. Определить полную работу A, совершенную газом, и конечную температуру Т газа.
= 2 раза. Определить полную работу A, совершенную газом, и конечную температуру Т газа. = 30, показатель адиабаты
= 30, показатель адиабаты  = 1,40. Вычислить удельные теплоемкости
= 1,40. Вычислить удельные теплоемкости 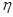 цикла Карно при повышении температуры нагревателя от Т1 = 380 К до Т1 = 590 К? Температура охладителя Т2 = 280 К.
цикла Карно при повышении температуры нагревателя от Т1 = 380 К до Т1 = 590 К? Температура охладителя Т2 = 280 К.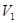 = 10 см3 до
= 10 см3 до  =16 см3? Считать процесс изотермическим.
=16 см3? Считать процесс изотермическим. = 1,4 мм и
= 1,4 мм и  = 1,2 мм в одну каплю?
= 1,2 мм в одну каплю? глицерина. Считать смачивание полным.
глицерина. Считать смачивание полным.


