ТЕМА 8. Ионно-молекулярные уравнения. Гидролиз солей
Ионно-молекулярные уравнения. В реакциях обмена, протекающих в растворах электролитов, наряду с недиссоциированными молекулами участвуют ионы, образующиеся при электролитической диссоциации исходных веществ либо продуктов реакции Реакция протекает самопроизвольно, если в результате образуется продукт, представляющий собой: а) малодиссоциирующее вещество, б) осадок, в) газообразное вещество. Механизм протекания реакций в растворах электролитов наиболее полно выражается при замене молекулярных уравнений ионно-молекулярными. В таких уравнениях слабые электролиты, малорастворимые соединения и газы записываются в молекулярной форме, а сильные электролиты в виде ионов. Например:
а) Na2S + 2HCl = 2NaCl + H2S↑; - молекулярное уравнение, 2Na+ + S2- + 2H+ + 2Cl- = 2Na+ + 2Cl- + H2S – полное ионно-молекулярное уравнение, S2- + 2H+ = H2S – сокращенное ионно-молекулярное уравнение;
б) СoSO4 + 2NaOH = Na2SO4 + Co(OH)2 ↓; - молекулярное уравнение, Сo2++ SO Со2+ + 2OH- = Co(OH)2 – сокращенное ионно-молекулярное уравнение;
в) Zn(OH)2 + 2КОH = К2ZnO2 + 2H2O - молекулярное уравнение, Zn(OH)2 + 2К++ OН- = 2К++ZnO22-+2H2O – полное ионно-молекулярное уравнение, Zn(OH)2 + 2OH- = ZnO22-+2H2O – сокращенное ионно-молекулярное уравнение;
г) (CuOH)NO3 + HNO3 = Cu(NO3)2 + H2O - молекулярное уравнение, CuOH+ + NO3- + H+ + NO3- = Cu2+ + 2NO3- + H2O – полное ионно-молекулярное уравнение, CuOH+ + H+ = Cu2+ + H2O – сокращенное ионно-молекулярное уравнение;
д) CaCO3 + 2HCl = CaCl2 + H2O + CO2↑; - молекулярное уравнение, CaCO3 + 2H++2Cl-= Ca2+ +2Cl- + H2O + CO2↑– полное ионно-молекулярное уравнение, CaCO3 + 2H+-= Ca2+ + H2O + CO2↑; – сокращенное ионно-молекулярное уравнение. В тех случаях, когда осадки или слабые электролиты имеются как среди исходных веществ, так и среди продуктов реакции, равновесие смещается в сторону образования менее диссоциирующих веществ. Гидролиз соли – пример реакции обмена в растворах электролитов, протекающей чаще всего в сторону образования малодиссоциирующих веществ. Гидролизом соли называется взаимодействие ионов растворенной соли с водой, сопровождающееся связыванием ионов воды с образованием малодиссоциирующих продуктов и изменением рН среды. Существуют следующие типы солей по отношению к гидролизу: 1) не подвергаются гидролизу: соли, образованные сильным основанием и сильной кислой (например NaCl); 2) подвергаются гидролизу: соли сильного основания и слабой кислоты (например
|

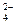 + 2Na +2OH- = 2Na+ + SO
+ 2Na +2OH- = 2Na+ + SO  ); соли слабого основания и сильной кислоты (например
); соли слабого основания и сильной кислоты (например  ); соли слабого основания и слабой кислоты
); соли слабого основания и слабой кислоты  ).
).


