Примеры решения задач. 1.Указать правильное выражение константы равновесия следующей реакции: S(k) + O2<=> SO2(г).
1.Указать правильное выражение константы равновесия следующей реакции: S(k) + O2 <=> SO2(г). а) Решение: Кр есть отношение произведения равновесных парциальных давлений газообразных продуктов реакции к произведению равновесных парциальных давлений исходных газообразных веществ, взятых в степенях, которые соответствуют коэффициентам в уравнении реакции. Тогда, для рассматриваемой реакции Ответ:в)
2. Определить, как изменится скорость прямой реакции А(г) + 2В(г) = 2С(г). если увеличить давление в системе в 2 раза. а) не изменится; Решение: а) определим зависимость между изменением парциального давления · · · увеличение общего давления в 2 раза равносильно увеличению парциального давления каждого компонента также в два раза: ·
б) применив закон действующих масс, определим изменение скорости реакции при изменении парциального давления каждого компонента в два раза:
Ответ: б) увеличится в 8 раз.
3. На основании принципа Ле Шателье определить направление смещения равновесия в следующей реакции: 2SO2(г) + O2(г) <=> 2SO3(г), ΔrH0(298K) = -284,2 кДж при: а) понижении температуры и б) повышении давления. 1а) ← б) → 2а) → б) ← 3а) ← б) не сместится 4а) → б) →
Смещение равновесия реакции зависит от знака ΔrH0(298K). Т.к. ΔrH0(298K)<0, т.е. реакция экзотермическая, то при понижении температуры равновесие сместится в сторону прямой реакции (→), идущей с выделением теплоты т.е. вправо. б) В соответствии с принципом Ле Шателье увеличение давления смещает равновесие в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением суммарного числа моль газообразных веществ.
Следовательно, при повышении давления равновесие системы смещается вправо (→). Ответ: 4а) → б) →.
4. Указать во сколько раз изменится скорость реакции, энергия активации, которой равна 60 кДж/моль: а) при повышении температуры от 320 до 360 К? б) если она протекает при 298 К в присутствии катализатора (
б) Зависимость скорости реакции от наличия катализатора выражается уравнением:
откуда Ответ: а) при повышении температуры от 320 до 360 К скорость реакции возрастает в 12,3 раза; б) в присутствии катализатора скорость реакции возрастает в 129 раз.
CO2(г) + С(к) <=> 2CO(г) ΔfH0(298K), кДж/моль -393,5 0 2(-110,5) S0(298K), Дж/моль, К 213,7 5,7 2(197,5) -2,3RTlgKp = ΔrH0(298K) – TΔrS0(298K) Если Кр = 1, то lgKp = 0, тогда ΔrH0(298K) - TΔrS0(298K) = 0, а
T =
где 103 – коэффициент пересчета кДж в Дж ΔrH0(298K) = 2ΔfH0(298K, CO(г)) – [ΔfH0(298K, CO2(г)) + ΔfH0(298K, Cк)] ΔrH0(298K) = 2·(-110,5) – [(-393,5) + 0] = 172,47 кДж. ΔrS0(298K) = 2 S0(298K, CO(г)) – [S0(298K, CO2(г)) + S0(298K, C(k))] = 2·197,5 – (213,7 + 5,74) = 175,6 Дж/К Т = Ответ: Кр = 1 при 982 К.
6.Вычислить константу равновесия для реакции: 4NH3(г) +3O2(г)<=>2N2(г) + 6H2O(г), если исходные концентрации NH3(г) и O2(г) соответственно равны 6,0 и 5,0 моль/л и равновесная концентрация N2(г) равна 1,8 моль/л.
а) Определим по уравнению реакции количества вещества всех компонентов, прореагировавших или образовавшихся в ходе реакции. Обозначим а – количество вещества аммиака, вступившего в реакцию. a х y z моль 4NH3(г) +3O2(г)<=>2N2(г) + 6H2O(г), 4 моль NH3 - 3 моль O2 4 моль NH3 - 2 моль N2 4 моль NH3 - 6 моль H2O а моль NH3 - х моль O2 а моль NH3 - 1,8 моль N2 а моль NH3 - z моль H2O х = х = б) определим равновесные концентрации исходных веществ и продуктов реакции. Примем объем системы равным 1 л. Тогда значения концентраций численно будут равны количествам вещества в равновесной смеси.
Константа равновесия Ответ: KC = 198,95
|

 ; б)
; б) 
 ; в)
; в) 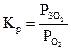 ; г)
; г) 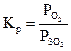

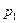 газообразного участника прямой реакции, изменением его концентрации
газообразного участника прямой реакции, изменением его концентрации  и увеличением общего давления в системе при условиях, что масса вещества в системе и температура системы не изменялись, т.е.
и увеличением общего давления в системе при условиях, что масса вещества в системе и температура системы не изменялись, т.е. 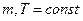 . Из уравнения Клапейрона-Менделеева следует:
. Из уравнения Клапейрона-Менделеева следует: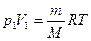 →
→  →
→ 
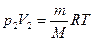 →
→  →
→ 
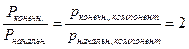
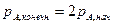 ,
, 

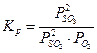


 = 48 кДж/моль)?
= 48 кДж/моль)?
 = 48кДж/моль
а)
= 48кДж/моль
а)  -?
а)
-?
а)  -?
-?
 =
= 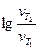 =
= 
 =
= 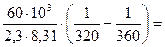 1,09
где 103 – коэффициент пересчета кДж в Дж, тогда
1,09
где 103 – коэффициент пересчета кДж в Дж, тогда
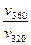 =101,09 = 12,3раза
=101,09 = 12,3раза
 =
= 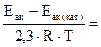
 2,11
2,11 = 102,11 ~ 129
= 102,11 ~ 129
 5.Используя справочные данные по ΔfH0(298K) и S0(298K) веществ, определить температуру при которой константа равновесия реакции CO2(г) + C(k) <=>2CO(г) равна единице. Записать выражение для константы равновесия данной реакции.
5.Используя справочные данные по ΔfH0(298K) и S0(298K) веществ, определить температуру при которой константа равновесия реакции CO2(г) + C(k) <=>2CO(г) равна единице. Записать выражение для константы равновесия данной реакции.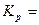
 Значения ΔfH0(298K) и S0(298K) веществ берем из табл.
Значения ΔfH0(298K) и S0(298K) веществ берем из табл.
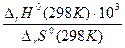
 =982K
=982K Расчет количеств, прореагировавших и образовавшихся веществ, производится по уравнению реакции.
Расчет количеств, прореагировавших и образовавшихся веществ, производится по уравнению реакции.
 а =
а = 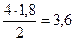 z =
z = 
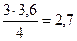 z =
z = 
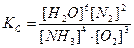 =
= 



