Примеры решения задач.
1. Указать соединение, в котором молярная масса эквивалента азота равна 7 г/моль: а) NO; б) NO2; в) N2O3. Решение: Молярная масса эквивалента азота равна а) б) в) Ответ: NO.
2. Указать правильное значение молярной массы эквивалента оксида хрома (III): а) 51,99 г/моль; б) 34,66 г/моль; в) 25,33 г/моль. Решение: Молярная масса эквивалента оксида хрома (III) равна сумме молярных масс эквивалентов химических элементов хрома и кислорода (в оксиде). а) б) в)
Ответ: 25,33 г/моль.
3. Указать правильное значение молярной массы эквивалента гидроксида алюминия в реакции Al(OH)3 + 2HCl = AlOHCl2 + 2H2O: а) 78 г/моль; б) 39 г/моль; в) 26 г/моль. Решение: В приведенной химической реакции степень окисления алюминия не изменяется.
Ответ: 39 г/моль.
4. Указать правильное значение молярной массы эквивалента ортофосфорной кислоты в реакции H3РО4 + КОН = KH2PO4 + H2O: а) 98 г/моль; б) 49 г/моль; в) 32,66 г/моль. Решение: Приведенная химическая реакция относится к реакциям обмена.
Ответ: а) 98 г/моль.
5. Трехвалентный элемент образует оксид, содержащий 68,90% масс. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
Ответ: Мэк(Э) = 3,61 г/моль; элемент – В (бор).
6. На восстановление 7,2 г оксида металла потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла.
б) используя определение молярной массы эквивалента сложного вещества как суммы молярных масс эквивалентов атомов, определим молярную массу эквивалента металла: Мэк(Окс) = Мэк(Ме) + Мэк(О); Мэк(Ме) = Мэк(Окс) - Мэк(О) = 36-8 = 28 г/моль Ответ: Мэк(Окс) = 36 г/моль; Мэк(Ме) = 28 г/моль
7. Хлорид некоторого металла массой 0,493 г обработали избытком раствора AgNO3 При этом образовалось 0,86 г AgCl. Вычислить молярную массу эквивалента металла.
|

 , где
, где 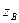 - валентность (степень окисления) азота в указанных оксидах.
- валентность (степень окисления) азота в указанных оксидах.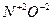 ,
, 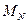 = 14 (г/моль),
= 14 (г/моль), 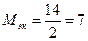 г/моль;
г/моль;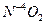 ,
, 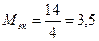 г/моль;
г/моль;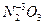 ,
, 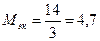 г/моль
г/моль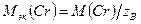 =
=  = 17,33 г/моль,
= 17,33 г/моль,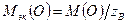 =
= 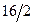 = 8 г/моль,
= 8 г/моль,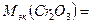
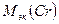 +
+ 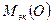 = 17,33 + 8 = 25,33 г/моль
= 17,33 + 8 = 25,33 г/моль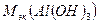 =
= 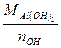 , где
, где 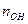 - число гидроксогрупп (две), замещенных в реакции на кислотный остаток (Cl-),
- число гидроксогрупп (две), замещенных в реакции на кислотный остаток (Cl-),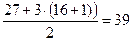 г/моль.
г/моль.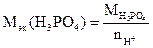 , где
, где  - число ионов водорода, замещенных в данной реакции на металл.
- число ионов водорода, замещенных в данной реакции на металл. 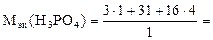 98 г/моль
98 г/моль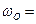 68,90% масс.
68,90% масс.

 ,
,
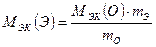
 = 8 г/моль (см. пример 2)
= 8 г/моль (см. пример 2)
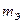 ,
,  - массы атомов химического элемента и кислорода в 100 г оксида.
- массы атомов химического элемента и кислорода в 100 г оксида.  г/моль
б) для того, чтобы назвать элемент, следует определить его относительную атомную массу
г/моль
б) для того, чтобы назвать элемент, следует определить его относительную атомную массу 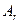 , численное значение которой равно численному значению его молярной массы:
, численное значение которой равно численному значению его молярной массы:
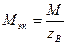
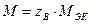 =
= 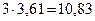 (г/моль)
Относительная атомная масса элемента равна 10,83, что соответствует
(г/моль)
Относительная атомная масса элемента равна 10,83, что соответствует  2,24 л
Мэк(Окс.) -?
Мэк(Ме) -?
2,24 л
Мэк(Окс.) -?
Мэк(Ме) -?


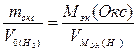 ,
Мэк(Окс) =
,
Мэк(Окс) = 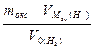 =
= 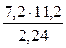 = 36 г/моль
= 36 г/моль
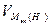 = 11,2 л/моль
= 11,2 л/моль = 0,493 г
= 0,493 г
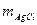 = 0,86 г
= 0,86 г
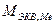 -?
-?

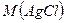 = 108 + 35,5 = 143,5 г/моль
143,5 г AgCl - 35,5 г Cl
0,86 г AgCl -
= 108 + 35,5 = 143,5 г/моль
143,5 г AgCl - 35,5 г Cl
0,86 г AgCl - 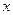
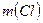 =
=  г
г
 г
б) используя закон эквивалентов, рассчитаем молярную массу эквивалента металла в исходном хлориде:
г
б) используя закон эквивалентов, рассчитаем молярную массу эквивалента металла в исходном хлориде:
 ,
, 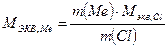
 г/моль
Ответ:
г/моль
Ответ: 


