- Двумолярный раствор разбавлен в 25 раз. Указать правильное значение полученной концентрации раствора (моль/л): а) 0,08; б) 0,25; в) 0,05; г) 0,04.
Решение:
 
|
Откуда следует: СВ(кон) = СВ(исх). / 25 = 2/25 = 0,08 моль/л
Ответ: СВ(кон) = 0,08 моль/л, а).
- Указать правильное значение нормальности раствора нитрата кальция, если его молярная концентрация составляет 0,5 моль/л. а) 0,5 моль/л; б) 1,5 моль/л; в) 0,15 моль/л; г) 1,0 моль/л.
Решение:
Молярная концентрация вещества: 
Нормальность: 
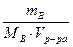 =
= 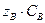

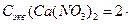
 = 0,5∙2=1,0 (моль/л)
= 0,5∙2=1,0 (моль/л)
Ответ: г) 1,0 моль/л
- Указать правильное значение массы вещества, содержащегося в 900 г 15%-ного раствора. а) 13,5 г; б) 95 г; в) 185 г; г) 135 г;
Решение:
 следовательно, следовательно, 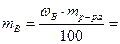 900 ∙ 0,15 = 135 (г). 900 ∙ 0,15 = 135 (г).
|
Ответ: г) 135 г
- Сколько граммов хлорида железа (III) содержится в 500 см3 0,1 н раствора?
| Дано:
Cэк(FeCl3) = 1н (0,1моль/л)
Vр-ра = 500 cм3 = 0,5 л
| Решение:
Молярная концентрация эквивалента  равна: равна: 
|

|
откуда  ,
,

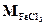 = 56 + 3 ∙ 35,5 = 162,5 г/моль
= 56 + 3 ∙ 35,5 = 162,5 г/моль
В – степень окисления железа (3),
n - число атомов железа в молекуле соли (1).

Тогда, 
где 10-3 - пересчет см3 в л.
Ответ: 
- Сколько граммов хлорида магния потребуется для приготовления 800 см3 25%-ного раствора плотностью 1,2г/см3?
Дано:
Vр-ра = 800 cм3
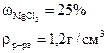
| Решение:
По определению  откуда откуда

|

|
mр-ра = Vр-ра · ρр-ра = 800 · 1,2 = 960 г.
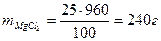
Ответ: 
- Определить молярную концентрацию растворенного вещества в растворе, содержащем 40 г сульфата меди (II) в 800 см3 раствора.
Дано:
Vр-ра = 800 мл
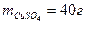
| РЕШЕНИЕ:
Молярная концентрация СuSO4 в растворе:  моль/л моль/л
|

|
где: 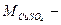 молярная масса сульфата меди (II), г/моль.
молярная масса сульфата меди (II), г/моль.
 = 64 + 32 + 64 = 160 г/моль
= 64 + 32 + 64 = 160 г/моль
Тогда  моль/л
моль/л
где 10-3 - пересчет см3 в л.
Ответ:  = 0,31 моль/л.
= 0,31 моль/л.
7.Определить моляльность растворенного вещества, если в 100 г раствора содержится 5,3 г карбоната натрия.
Дано:
mр-ра = 100 г
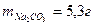
| Решение:
Моляльность Na2CO3 в растворе:

|

|
Массу воды определяем из условия:

Следовательно: 
где 1000 - коэффициент пересчета г в кг.
Ответ:  моль/кг.
моль/кг.
8. Определить титр растворенного вещества если в 200 см3 этого раствора содержится 0,1 моль гидроксида калия.
Дано:
Vр-ра = 200 cм3

| Решение:
Титр растворенного вещества определяем по формуле:
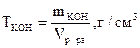
|

|
Согласно условию задачи: 
откуда mKOH = 0,1 · MKOH = 0,1 · 56 = 5,6 г, где МКОН = 39 + 16 + 1 = 56 г/моль.

Ответ:  = 0,028 г/см3.
= 0,028 г/см3.
9. Определить молярную долю растворенного вещества в 3,42%-ном растворе сахарозы (С12Н22О11).
Дано:

| Решение:
Молярную долю сахарозы в в растворе определяем по
формуле:
|
χ  -? -?
|
χ  =
= 
где: m  и m
и m  - соответственно массы сахарозы и воды, г.
- соответственно массы сахарозы и воды, г.
М  и М
и М  - соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
- соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
Массы сахарозы и воды определяем согласно условию задачи (3,42%-ный раствор сахарозы).
Следовательно, в 100 г раствора содержится 3,42 г С12Н22О11,
m  = 100 - 3,42 = 96,58 г
= 100 - 3,42 = 96,58 г
χ  =
= 
Ответ: χ  = 0,00186.
= 0,00186.






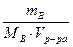 =
= 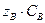

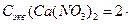
 = 0,5∙2=1,0 (моль/л)
= 0,5∙2=1,0 (моль/л) следовательно,
следовательно, 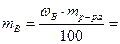 900 ∙ 0,15 = 135 (г).
900 ∙ 0,15 = 135 (г).
 равна:
равна: 

 ,
,
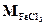 = 56 + 3 ∙ 35,5 = 162,5 г/моль
= 56 + 3 ∙ 35,5 = 162,5 г/моль


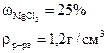
 откуда
откуда


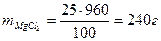

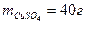
 моль/л
моль/л

 молярная масса сульфата меди (II), г/моль.
молярная масса сульфата меди (II), г/моль. = 64 + 32 + 64 = 160 г/моль
= 64 + 32 + 64 = 160 г/моль моль/л
моль/л = 0,31 моль/л.
= 0,31 моль/л.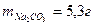




 моль/кг.
моль/кг.
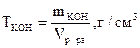



 = 0,028 г/см3.
= 0,028 г/см3.
 -?
-?

 - соответственно массы сахарозы и воды, г.
- соответственно массы сахарозы и воды, г.



