ТЕМА 4. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ.
Химические свойства вещества определяют возможности практического использования его в различных отраслях общественного производства и потребления. Основой практического использования веществ является знание процессов их взаимодействия, при которых из определенных исходных веществ можно получить вещества – продукты реакции с заданными свойствами. Многочисленность и многообразие химических веществ делает невозможным экспериментальное изучение всех возможных химических реакций между ними. Одна из основных задач химии, решаемая на протяжении ее многовекового развития – на основании теоретических законов найти критерии, позволяющие предсказать возможность протекания определенных химических реакций. Один из таких подходов основан на фундаментальном законе природы - законе сохранения и превращения энергии. Термохимия. Экзотермические и эндотермические химические реакции. При химических реакциях происходит разрушение химических связей в исходных веществах за счет поглощаемой энергии извне и образование химических связей в веществах – продуктах реакции с выделением энергии. Суммарным результатом процесса является либо выделение теплоты (
где с- удельная теплоемкость.
Термодинамические критерии возможности протекания химических процессов. Течениехимических процессов в общем случае сопровождается: · разрывом и образованием химических связей, количественным выражением чего является величина теплового эффекта · механическим перемещением структурных единиц в пространстве, выражением чего является величина совершаемой работы · изменением упорядоченности системы, выражением чего является изменение энтропии Первый закон термодинамики является выражением закона сохранения и превращения энергии при механических и тепловых процессах, позволяет проводить вычисления тепловых эффектов химических процессов при постоянных давлении или объеме на основании следствия, известного как закон Гесса. Формулировка первого закона термодинамики: теплота (
Внутренняя энергия системы представляет собой сумму всех видов энергии движения и взаимодействия частиц системы. Внутренняя энергия системы возрастает, если к системе подвести некоторое количество теплоты Q (нагреть). Внутренняя энергия системы уменьшается, если система совершает работу W против внешних сил. Изменение внутренней энергии системы не зависит от условий проведения процесса, определяется только ее начальным и конечным состояниями, т.е.
при при
Формулировка закона Гесса: тепловой эффект химической реакции, протекающей при постоянном объеме или постоянном давлении, не зависит от пути ее протекания, а определяется только состоянием исходных веществ и продуктов реакции. Математическим выражением закона Гесса являются уравнения (3.3). Практические расчеты изменений энтальпии в ходе химических реакций проводят, используя три следствия закона Гесса: Следствие 1. Изменение энтальпии (тепловой эффект) химической реакции Следствие 2. Изменение энтальпии (тепловой эффект) химической реакции равно сумме стандартных энтальпий сгорания [ ΔflHºТ ] исходных веществ за вычетом суммы стандартных энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов. Следствие 3. С термохимическими уравнениями можно проводить такие же действия, как с алгебраическими уравнениями (складывать, вычитать, умножать и делить на постоянное число). Второе начало термодинамики определяет наличие у систем функции состояния - энтропии, изменение которой определяет возможность самопроизвольного протекания процессов в изолированных системах: все процессы в изолированных системах протекают самопроизвольно таким образом, что энтропия Изменение энергии Гиббса химической реакции
Величина изменения энергии Гиббса является функцией состояния системы, Самопроизвольно протекают химические реакции, для которых
Таблица 4.1
|

 в экзотермических рекциях), либо поглощение теплоты (
в экзотермических рекциях), либо поглощение теплоты ( в эндотермических реакциях). Термохимия – раздел химии, занимающийся изучением тепловых эффектов химических и физико-химических процессов. Основные понятия, используемые в термохимии:
в эндотермических реакциях). Термохимия – раздел химии, занимающийся изучением тепловых эффектов химических и физико-химических процессов. Основные понятия, используемые в термохимии: ,
,  ; самопроизвольно протекают большинство экзотермических химических реакций,
; самопроизвольно протекают большинство экзотермических химических реакций,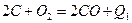 или
или  ;
; ;
;  , (4.1)
, (4.1)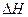 ) системы в ходе процесса,
) системы в ходе процесса, ,
, .
. ,
,  ) которая подводится к системе, расходуется на увеличение ее внутренней энергии (
) которая подводится к системе, расходуется на увеличение ее внутренней энергии ( , ΔU) и совершение работы против внешних сил (
, ΔU) и совершение работы против внешних сил ( ,
, 
 (4.2)
(4.2) . Тепловой эффект реакции, совершаемая работа зависят от условий проведения процесса и только в случае постоянства давления или объема в реакционной системе определяются природой и состоянием исходных веществ и продуктов реакции:
. Тепловой эффект реакции, совершаемая работа зависят от условий проведения процесса и только в случае постоянства давления или объема в реакционной системе определяются природой и состоянием исходных веществ и продуктов реакции:
 ,
,
 =
=  =
=  =
=  - тепловой эффект химической реакции при постоянном объеме,
- тепловой эффект химической реакции при постоянном объеме, - тепловой эффект химической реакции при постоянном давлении,
- тепловой эффект химической реакции при постоянном давлении, - изменение энтальпии при химической реакции, не зависящее от пути процесса, как и
- изменение энтальпии при химической реакции, не зависящее от пути процесса, как и  .
. равно сумме стандартных энтальпий образования [
равно сумме стандартных энтальпий образования [  ] продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов.
] продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ с учетом стехиометрических коэффициентов. системы не убывает
системы не убывает  . Изменение энтропии при химической реакции равно разности стандартных значений абсолютных энтропий продуктов за вычетом стандартных значений абсолютных энтропий исходных веществ с учетом стехиометрических коэффициентов.
. Изменение энтропии при химической реакции равно разности стандартных значений абсолютных энтропий продуктов за вычетом стандартных значений абсолютных энтропий исходных веществ с учетом стехиометрических коэффициентов. учитывает изменение энтропии и изменение энтальпии:
учитывает изменение энтропии и изменение энтальпии: =
=  - T
- T 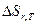 или
или  =
= 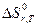 (4.4)
(4.4)


