Примеры решения задач. 1. Указать, какая из реакций является эндотермической в стандартных условиях при Т=298 К:
1. Указать, какая из реакций является эндотермической в стандартных условиях при Т=298 К: а) Mn(к) + 1/2O2(г) = MnO(к) б) 1/2N2(г) + 3/2H2(г) = NH3(г) в) S(к) + O2(г) = SO2(г) г) 1/2N2(г) + 1/2O2(г) = NO(г) Решение: Т.к. данные реакции являются реакциями образования 1 моль вещества из простых веществ, то изменение энтальпии приведенных процессов есть стандартная энтальпия образования веществ – продуктов реакции. Для определения теплового эффекта реакций выписываем из таблицы 3.1 значения энтальпий образования каждого из продуктов:
Реакции а, б, в – имеют отрицательные значение изменения энтальпии, а реакция г – положительное значение изменения энтальпии. Эндотермическими являются те реакции изменения энтальпии, которых имеют положительные значения. Ответ: г).
2. Без расчета определить, для какой из перечисленных реакций изменение энтропии имеет положительное значение: а) CO(г) + H2(г) = C(к) + H2O(г) б) 2Cu(NO3)2(к) = 2CuO(к) + 4NO2(г) + O2(г) в) 2NaHSO4(к) + CO2(г) + H2O(ж) = H2SO4(ж) + Na2CO3(к) г) CO(г) + 2H2(г) = CH3OH(ж) Решение: Энтропия увеличивается, если в ходе реакции возрастает количество вещества газов (моль) в системе.
1 моль 1 моль 1 моль а) CO(г) + H2(г) = C(к) + H2O(г) ,
б) 2Cu(NO3)2(к) = 2CuO(к) + 4NO2(г) + O2(г)
в) 2NaHSO4(к) + CO2(г) + H2O(ж) = H2SO4(ж) + Na2CO3(к)
г) CO(г) + 2H2(г) = CH3OH(ж)
При протекании реакций а, в и г наблюдается уменьшение количество вещества газов (моль) в системе, а в реакции б - увеличение. Следовательно, изменение энтропии данной реакции имеет положительное значение. Ответ: б).
3. Рассчитать изменение стандартных энтальпии и энтропии химической реакции 4HCl(г) + O2(г) = 2Н2О(г) + 2Сl2(г) при Т = 298 К. Решение: Изменение стандартных энтальпии и энтропии химической реакции рассчитываем исходя из первого следствия закона Гесса:
= [2∙0 + 2∙(-241,84)] - [4∙(-92,3) + 0] = -483,68 + 369,2 = - 114,48 (кДж/моль)
= (2∙222,9 + 2∙188,7) – (4∙186,8 + 205) = -129 (Дж/моль∙К)
Ответ:
4. Стандартная энтальпия сгорания этилена (С2Н4) равна (-1410,8) кДж/моль. Написать термохимическое уравнение сгорания этилена и вычислить стандартную энтальпию образования этилена при Т =298 К. Решение: Уравнение реакции горения этилена: C2H4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж). Термохимическое уравнение сгорания этилена: C2H4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж)+1410,8 кДж Стандартной энтальпией сгорания вещества
-1410,8 = 2(-285,8) + 2(-393,5) -
Ответ:
5. По заданным термохимическим уравнениям рассчитать стандартную энтальпию реакции образования Fe2O3 (к) из простых веществ при 298 К. 2Fe(к) + O2(г) = 2FeO(к) DrHo 1 = - 430 кДж (1) 4FeO(к) + O2(г) = 2Fe2O3(к) DrHo2 = - 584 кДж (2)
Решение:
2Fe(к) + O2(г) = 2FeO(к) (1) 2Fe(к) + O2(г) = 2FeO(к) 4FeO(к) + O2(г) = 2Fe2O3(к) (2)/2 2FeO(к) + ? 2Fe(к) +
(уравнение 1) + (уравнение 2)/2 = уравнение (3) 2Fe(к) + O2(г) + 2FeO(к) + 2Fe(к) + Аналогичные математические действия осуществляем и с тепловыми эффектами приведенных реакций:
- 430 +
Ответ:
5. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ.
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции за единицу времени: а) в единице объема системы (для гомогенной реакции):
б) на единице площади поверхности раздела фаз (для гетерогенной реакции):
Так как изменения концентраций участвующих в реакции веществ находятся в стехиометрической зависимости друг от друга, то для выражения скорости химической реакции может быть взято изменение концентрации любого из участвующих в реакции веществ. Скорость реакции зависит от природы реагирующих веществ, от их концентрации, от температуры, присутствия в системе катализатора и дисперсности твердой фазы в гетерогенных реакциях. Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действия масс: скорость химической реакции (
где с А и с В – молярные концентрации реагирующих веществ, моль/л; m, n, р – стехиометрические коэффициенты; k – константа скорости реакции, которая зависит от температуры и присутствия в системе катализатора, но не зависит от концентраций реагирующих веществ. Если наряду с жидкими или газообразными веществами в реакции участвуют также и твердые вещества, концентрация которых постоянна (гетерогенные реакции), то скорость реакции зависит от дисперсности твердой фазы:
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа: при повышении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2 – 4 раза:
Зависимость константы скорости реакции от энергии активации (Е а, кДж/моль) и температуры выражается уравнением Аррениуса
где А – предэкспоненциальный множитель; е – основание натурального логарифма (2,718…); R – универсальная газовая постоянная (8,314 Дж·моль-1 ·К-1); Т – температура, К; Е а - энергия активации, т.е. минимальная избыточная энергия (по сравнению со значением средней энергии реагирующих молекул), которой должны обладать молекулы, чтобы реакция стала возможной. В общем случае, если температура реакции изменилась от
Скорость химических реакций возрастает в присутствии катализатора. Зависимость скорости реакции от наличия в системе катализатора выражается следующим уравнением:
где Химическое равновесие. Реакции, протекающие одновременно в двух взаимно противоположных направлениях, называют обратимыми. Реакцию, протекающую слева направо, называют прямой, а справа налево – обратной. В начале процесса, когда концентрация исходных веществ велика, а конечных продуктов мала, скорость прямой реакции больше обратной. По мере уменьшения концентраций исходных веществ и увеличения концентраций продуктов реакции, скорость прямой реакции уменьшается, а скорость обратной реакции возрастает. Через некоторое время эти скорости становятся равными и наступает состояние химического равновесия. При этом прямая и обратная реакция протекают таким образом, что концентрации всех участников реакции (исходных веществ и продуктов) не изменяются во времени при постоянных внешних условиях. Эти концентрации называют равновесными концентрациями. Состояние химического равновесия характеризуется константой равновесия.
где n, m, p, q – стехиометрические коэффициенты в уравнении реакции;
Константа равновесия может быть выражена также через парциальные давления веществ - участников реакции. Например для реакции 2А(г) + В(г)
где РС, РА, РВ – равновесные парциальные давления реагирующих газообразных веществ. Для реакций, протекающих в гетерогенной системе, концентрации и парциальные давления паров веществ, находящихся в конденсированном состоянии, в выражение константы равновесия не входят. Например для реакций: CaCO3(k) 4Fe(к) +3О2 <=> 2Fe2О3 Константа равновесия химической реакции связана с изменением стандартной энергии Гиббса реакции уравнением:
В целом константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения исходных веществ в конечные. Смещение химического равновесия.Система будет находиться в состоянии равновесия до тех пор, пока внешние условия (температура, давление, объем и концентрация), остаются неизменными. При изменении условий, система переходит в новое равновесное состояние, устанавливаются другие равновесные концентрации, соответствующие новым условиям. Это называют смещением химического равновесия. Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, путем изменения давления (P), объема (V), температуры (T), концентрации (С), то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
|

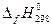 (MnO(к)) = - 754,4 кДж/моль;
(MnO(к)) = - 754,4 кДж/моль; (моль, газов) = 1 – (1+1)= -1 ˂ 0 (убывает),
(моль, газов) = 1 – (1+1)= -1 ˂ 0 (убывает),

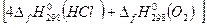 =
=

 =
= кДж/моль
кДж/моль
 , Дж/(моль·К)
, Дж/(моль·К)
 называется тепловой эффект реакции полного сгорания 1 моль данного вещества до СО2(г) и Н2О(ж) при стандартных условиях. Следовательно:
называется тепловой эффект реакции полного сгорания 1 моль данного вещества до СО2(г) и Н2О(ж) при стандартных условиях. Следовательно: )Ж + 2
)Ж + 2  )] - [3
)] - [3  O2(г) = Fe2O3(к)
O2(г) = Fe2O3(к)  O2(г) = Fe2O3(к) (3)
O2(г) = Fe2O3(к) (3) ,
,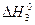 = -822 кДж/моль.
= -822 кДж/моль. (моль/л∙с, моль/л∙мин) (5.1)
(моль/л∙с, моль/л∙мин) (5.1) (моль/л∙с, моль/л∙мин) (5.2)
(моль/л∙с, моль/л∙мин) (5.2) - скорость химической реакции; D с – изменение концентрации вещества; Dt – время течения реакции, за которое концентрация некоторого вещества изменилась на D с.
- скорость химической реакции; D с – изменение концентрации вещества; Dt – время течения реакции, за которое концентрация некоторого вещества изменилась на D с.
 (5.3)
(5.3) (5.4) где с– концентрация газообразного или жидкого вещества, моль/л; S – площадь поверхности твердой фазы.
(5.4) где с– концентрация газообразного или жидкого вещества, моль/л; S – площадь поверхности твердой фазы. (5.5) γ – температурный коэффициент скорости реакции (g = 2¸4), когда
(5.5) γ – температурный коэффициент скорости реакции (g = 2¸4), когда  .
. (5.6)
(5.6) до
до 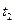 ,уравнение (4.6) преобразуется к виду:
,уравнение (4.6) преобразуется к виду: (5.7)
(5.7) (5.8)
(5.8)
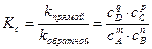 (5.9)
(5.9) – равновесные концентрации конечных и исходных веществ (моль/л);
– равновесные концентрации конечных и исходных веществ (моль/л); - константы скоростей прямой и обратной реакций.
- константы скоростей прямой и обратной реакций.  2С(г)
2С(г) (5.10)
(5.10) ;
;
 ,
,  =
=  (5.11)
(5.11)


