ТЕМА 7. РАСТВОРЫ СИЛЬНЫХ И СЛАБЫХ ЭЛЕКТРОЛИТОВ.
Диссоциация электролитов. При растворении электролитов в полярных растворителях они в различной степени распадаются на катионы и анионы. Этот процесс называется электролитической диссоциацией. Электролиты, не все молекулы которых в растворе диссоциируют на ионы, называются слабыми. К ним относятся вода, гидроксид аммония, труднорастворимые гидроксиды, минеральные кислоты (H2CO3, H2S, HCN, HNO2, H2SiO3, H3BO3, HClO, H3AsO3) и почти все органические кислоты (CH3COOH, HCOOH и др.). В результате электролитической диссоциации в растворе устанавливается равновесие, характеризующееся определенным значением константы равновесия (константы электролитической диссоциации) и постоянством равновесных концентраций молекул и ионов. Электролитическая диссоциация слабых электролитов может протекать в несколько стадий (ступеней), каждой из которых соответствует свое значение константы электролитической диссоциации. Например:
1 ступень: 2 ступень:
Для слабых электролитов, у которых степень электролитической диссоциации α<<1:
Константа диссоциации слабых электролитов по первой ступени всегда значительно больше константы диссоциации по второй ступени: К1 >> К2, поэтому практически в расчетах учитывают только первую ступень. Концентрация ионов, образующихся при диссоциации сильных и слабых электролитов рассчитывается по уравнению:
Сиона = Сэл-та·
где Сэл-та – молярная концентрация электролита, моль/л
Nиона – число ионов данного вида образующихся при полной диссоциации
Таблица 7.1 Константы диссоциации некоторых слабых электролитов в водных растворах при 25оС
Электролиты, практически полностью диссоциирующие в воде, называются сильными электролитами (табл. 7.2).
Таблица 7.2 Сильные электролиты
Произведение растворимости. Приконтакте малорастворимых веществ с растворителем (водой) в раствор переходит малое количество вещества, соответствующее его растворимости при определенной температуре. При этом над твердой фазой (осадком) образуется насыщенный раствор малорастворимого вещества с очень малой концентрацией. Если малорастворимое вещество электролит, то растворенное его количество в растворе полностью диссоциирует на ионы. Равновесие в насыщенном растворе малорастворимого электролита устанавливается между его твердой фазой (осадком) и ионами, образующимися в результате электролитической диссоциации растворенной части электролита. Например: Са3(РО4)2(кр) ↹ 3Са2+(р-р) + 2РО43-(р-р) Константа равновесия в этом случае называют произведением растворимости (ПР):
Произведение растворимости (ПР) есть произведение концентраций ионов малорастворимого электролита в его насыщенном растворе в степенях их стехиометрических коэффициентов. ПР есть величина постоянная при данной температуре. Ионное произведение воды. Водородный показатель. Вода, являясь слабым электролитом, в незначительной степени диссоциирует:
Н2О ↹ Н+ + ОН К К К
Концентрация ионов в воде очень мала: [Н+] = [ОН
Водородный показатель
Примеры решения задач: 1. Указать пару правильных выражений ПР для следующих соединений: PbCl2 и Ag2SO4. а) ПР б) ПР в) ПР г) ПР
Ответ: в) ПР
2. Указать пару правильных уравнений диссоциации и выражений констант электролитической диссоциации для следующих соединений: H2S, Fe(OH)2.
в) H2S ↹2 H
г) H2S ↹ 2H
Решение: Так как, H2S и Fe(OH)2 – слабые электролиты, то их диссоциация протекает равновесно по первой ступени (см. раздел 7.1). Ответ: б) H2S ↹ H Fe(OH)2 ↹ FeOH+ + OH-,
3. Указать ряд в котором водные растворы всех соединений являются сильными электролитами: а) Al(OH)3; HCl; Na2SO4 б) H2CO3; CaCO3; NaCl в) HCl; AgNO3; ZnCl2 г) NaOH; H2S; KNO3. Решение: См. табл. 7.2. Ответ: в) соляная кислота HCl; соли AgNO3; ZnCl2. 4. Вычислить рН следующих водных растворов: а) 0,02 М HCl, б) 0,2 М KOH.
Решение:
а) HCl = H+ + Cl -; C HCl - сильный электролит, α = 1; N
б) В водных растворах слабых электролитов и разбавленных растворах сильных электролитов
KOH = К+ + ОН-; C КОН - сильный электролит, α = 1,
Ответ: рН 0,02 М HCl равно 1,7; рН 0,2 М КОН равно 13,3.
5. Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl).
Решение: HOCl ↹ H+ + OCl-,
HOCl - слабый электролит.
Ответ: рН 0,05 М HOCl равен 4,3. 6. Определить произведение растворимости MgF2, если его растворимость в воде при 250С равна 1,17 · 10-3 моль/л.
Решение: MgF2 ↹ Mg2+ + 2F-, NMg=1, N ПР [ Mg2+ ] = C [ Mg2+ ] = 1,17 · 10-3 · 1 · 1 = 1,17 · 10-3 моль/л [ F- ] = 1,17 · 10-3 · 1 · 2 = 2,34 · 10-3 моль/л.
ПР Ответ: ПР
|

 ↹
↹  +
+  ;
;  =
=  = 4,5·10-7,
= 4,5·10-7, ;
;  =
=  = 4,7·10-11
= 4,7·10-11
 или
или 
 , (7.1)
, (7.1)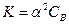 ,
,  (7.2)
(7.2) ·Nиона, (7.3)
·Nиона, (7.3) (7.4)
(7.4)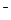 ;
; 
 ∙ [Н2О] = [Н+]∙[ОН
∙ [Н2О] = [Н+]∙[ОН  (7.5)
(7.5) в логарифмическом виде:
в логарифмическом виде: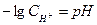 (7.6)
(7.6) в химически чистой воде
в химически чистой воде 
 = 7, такая среда называется нейтральной, так как концентрации ионов
= 7, такая среда называется нейтральной, так как концентрации ионов  > 10-7 моль/л (кислая среда),
> 10-7 моль/л (кислая среда),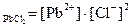 ПР
ПР 
 ПР
ПР 
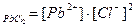 ПР
ПР  ПР
ПР  + HS-
+ HS-
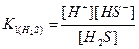 б) H2S ↹ H
б) H2S ↹ H 

 Fe(OH)2 ↹ FeOH+ + OH-
Fe(OH)2 ↹ FeOH+ + OH-

 + S2- Fe(OH)2 = FeOH+ + OH-
+ S2- Fe(OH)2 = FeOH+ + OH-

 =
= 
 = CНСl · α · N
= CНСl · α · N 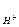 = 0.02∙1∙1=0,02 моль/л
= 0.02∙1∙1=0,02 моль/л = 1,7
= 1,7 = [Н+]∙[ОН
= [Н+]∙[ОН  ] = 10-14;
] = 10-14;  , где
, где 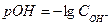
 = Cкон · α ·
= Cкон · α ·  = 0,2∙1∙1=0,2 моль/л
= 0,2∙1∙1=0,2 моль/л
 = 0,05 М
= 0,05 М
 ,
, 
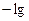 (CНСl ·
(CНСl ·  N
N  ∙1)= 4,3
∙1)= 4,3 = 1,17·10-3 моль/л
= 1,17·10-3 моль/л
 =24;
=24; 
 , [ F- ] = C
, [ F- ] = C 


