Лабораторная работа 1. Основные классы неорганических соединений
Основные классы неорганических соединений Цель работы: изучить классы неорганических соединений, научиться составлять уравнения реакций. Задание: провести опыты по получению основного и кислотного оксидов, основания, кислоты, основной соли, определить их химические свойства. Выполнить требования к результатам опытов, оформить отчет, решить задачу. Теоретическое введение Все вещества делятся на простые и сложные. Сложные вещества подразделяются на классы: оксиды, кислоты, основания, соли. Оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2. По химическим свойствам оксиды делятся на основные, кислотные и амфотерные (табл. 1.1). Таблица 1.1 Химические свойства оксидов
Одним из способов получения оксидов является взаимодействие простых веществ с кислородом: 2Са + O2 = 2СаO; С + O2 = СО2. Кислоты – сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка (HNO3, HCl, H2SO4, Н3РО4). Кислоты взаимодействуют 1. С основаниями с образованием соли и воды: 2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O. 2. С основными и амфотерными оксидами с образованием соли и воды: 2HCl + ВаO = ВаCl2 + H2O; 3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O. 3. С солями с образованием новой соли и новой кислоты: H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3. Одним из способов получения кислот является взаимодействие кислотного оксида с водой: P2O5 + 3H2O = 2H3PO4. Основания – сложные вещества, состоящие из атомов металла, связанных с одной или несколькими гидроксогруппами (NaOH, Cu(OH)2, Fe(OH)3). Основания взаимодействуют 1. С кислотами с образованием соли и воды: 2NaOH + H2SO4 = Na2SO4 + 2H2O. 2. С кислотными и амфотерными оксидами с образованием соли и воды: 2KOH + N2O5 = 2KNO3 + H2O; 2NaOH + Al2O3 + 3Н2О = 2Na[Al(OH)4]; 2NaOH + Al2O3 3. С солями с образованием новой соли и нового основания: 2NaOH + MgCl2 = Mg(OH)2↓ + 2NaCl. Растворимые в воде основания (щелочи) получают взаимодействием активных металлов или их оксидов с водой: 2Na + 2H2O = 2NaOH + H2↑; BaO + H2O = Ba(OH)2. Нерастворимые в воде основания получают реакцией обмена: Fe2(SO4)3 + 6KOH = 2Fe(OH)3↓ + 3K2SO4. Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками. Средние соли (К2SO4, Na3PO4) – это продукты полного замещения водорода в кислоте на металл или гидроксогрупп в основании на кислотные остататки: H2SO4 + 2KOH = K2SO4 + 2H2O; Mg(ОН)2 + 2HCl = MgCl2 + 2Н2О. Кислые соли (Сa(HCO3)2, Nа2НРО4) – это продукты неполного замещения водорода в кислоте на металл: KOH + H2SO4 = KHSO4 + H2O. Кислые соли образуют только многоосновные кислоты, например H2SO4, Н3РО4, Н2СО3, H2S. Основные соли (СuOHNO3, AlOHCl2) – это продукты неполного замещения гидроксогрупп в основании на кислотные остатки: Fe(ОН)3 + HNO3 = Fe(OH)2NO3 + 2Н2О; Fe(ОН)3 + 2HNO3 = FeOH(NO3)2 + 2Н2О. Основные соли образуют только многокислотные основания, например Сu(OH)2, Fe(OH)3, Mg(ОН)2.
|

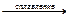 K2BeO2 + H2O;
BeO + 2KOH + H2O = K2[Be(OН)4]
K2BeO2 + H2O;
BeO + 2KOH + H2O = K2[Be(OН)4]



