Электролиты и электролитическая диссоциация
Хорошо известно, что одни вещества в растворенном или расплавленном состоянии проводят электрический ток, другие в тех же условиях ток не проводят. По электрической проводимости растворов или расплавов все вещества делят на электролиты и неэлектролиты. Электролиты Электролитами называют вещества, которые в расплавах или в растворах при взаимодействии с растворителем распадаются на ионы (диссоциируют). Ионы – это заряженные частицы, образованные из одного или нескольких атомов. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Важным понятием теории электролитической диссоциации является понятие о степени диссоциации.
– это процесс распада электролита на ионы при растворении в воде или расплавлении. Степень диссоциации α – это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N). α = n/N Степень диссоциации α может изменяться от 0 (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации часто выражают в процентах. Электролиты со степенью диссоциации больше 30% называют сильными, со значениями α от 3 до 30% – средними, менее 3% – слабыми электролитами. Растворы сильных электролитов в результате полной диссоциации содержат в основном ионы, а растворы слабых электролитов содержат в основном нераспавшиеся (недиссоциированные) молекулы и небольшую часть ионов. К сильным электролитам относят: а) практически все растворимые соли; б) кислоты: H2SO4, HNO3, HCl, HBr, HI, HClO4, HMnO4 и некоторые другие; в) растворимые основания (щелочи) – гидроксиды металлов IA и IIA групп периодической системы. К слабым электролитам относят остальные кислоты и основания, воду и другие вещества. При диссоциации молекулы электролитов (кислот, солей, оснований) распадаются на положительно заряженные ионы, называемые катионами и отрицательно заряженные ионы, называемые анионами. Катионы и анионы в растворе химически связаны с молекулами воды – гидратированы, но для простоты написания уравнений электролитической диссоциации в них обычно гидратацию не показывают.
Кислоты Диссоциация кислот: HCl HNO3 Диссоциация многоосновных кислот происходит ступенчато: первая ступень H2S вторая ступень HS- Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода (H+). Именно катионы водорода обусловливают общие свойства всех кислот: кислый вкус, изменение окраски индикаторов, взаимодействие с металлами, основными оксидами, основаниями.
Основания
Диссоциация оснований: NaOH D Na+ + OH- KOH D K+ + OH- Диссоциация многокислотных оснований происходит ступенчато: первая ступень Ba(OH)2 D BaOH+ + OH- вторая ступень BaOH+ D Ba+ + OH- Из уравнений диссоциации видно, что общим для всех оснований является присутствие в растворе гидроксид-ионов(OH-).
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH-). Именно гидроксид-ионы обусловливают общие свойства всех оснований: изменение окраски индикаторов (для растворимых оснований – щелочей), взаимодействие с кислотными оксидами, с кислотами, с растворами солей.
Соли Диссоциация солей: NaCl " Na+ + Cl- K2CO3 " 2K+ + CO32- Диссоциация практически всех растворимых солей происходит сразу, полностью и необратимо. Таким образом, соли являются сильными электролитами. Общих ионов для разных солей в растворе нет.
Соли – это сильные электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
|

 Электролитическая диссоциация
Электролитическая диссоциация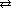 H+ + Cl-
H+ + Cl-


