Оксиды-сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
| Формула
| Название
| Формула
| Название
|
| CO
| оксид углерода (II)
| Fe2O3
| оксид железа (III)
|
| NO
| оксид азота (II)
| CrO3
| оксид хрома (VI)
|
| N2O5
| оксид азота (V)
| Mn2O7
| оксид марганца (VII)
|
ПОЛУЧЕНИЕ ОКСИДОВ.
| Окисление кислородом
| простых веществ
| 2Mg +O2=2MgO
|
| сложных веществ
| 2H2S+3O2=2H2O+2SO2
|
| Разложение
| нагреванием солей
| СaCO3=CaO+CO2 
|
| нагреванием оснований
| Cu (OH)2=CuO+H2O
|
| нагреванием кислородсодержащих кислот
| H2SO3=H2O+SO2 
|
| нагреванием высших оксидов
| 4CrO3=Cr2O3+3O2 
|
| Окисление низших оксидов
| 4FeO+O2=2Fe2O3
|
| Вытеснение летучего оксида менее летучим
| Na2CO3+SiO2=Na2SiO3+CO2 
|
КЛАССИФИКАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ.

|
| Основные-реагируют с избытком кислоты с образованием соли и воды. Основным оксидам соответствуют основания.
1.Взаимодействие с водой(оксиды щелочных и щелочноземельных мет.)
CaO+H2O=Ca(OH)2
2.Все-с кислотами
МgO+2HCl=MgCl2+H2O
3.С кислотными оксидами
CaO+CO2=CaCO34.С амфотерными оксидами Li2O+Al2O3=2LiAlO2
| Амфотерные (ZnO, Al2O3,Cr2O3, MnO2)
1.Взаимодействуют как с кислотами, так и с основаниями.
ZnO+2HCl=ZnCl2+H2O
ZnO+2NaOH+H2O=Na2[Zn(OH)4]
2.Реагируют с основными и кислотными оксидами
ZnO+CaO=CaZnO2
ZnO+SiO2=ZnSiO3
| Кислотные-реагируют с избытком щелочи с образованием соли и воды. Кислотным оксидам часто соответствуют кислоты.
1.Большинство взаимодействуют с водой
SO3+H2O=H2SO4
2.Со щелочами
NaOH+SiO2=Na2SiO3+H2O
3.С основными оксидами
SiO2+CaO=CaSiO3
4.С амфотерными оксидами
Al2O3+3SO3=Al2(SO4)3
|
Кислоты.
Рассмотрим, что происходит при растворении кислот в воде и запишем соответствующие уравнения.
Диссоциация кислот:
HCl 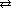 H+ + Cl-
H+ + Cl-
HNO3 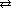 H+ + NO3-
H+ + NO3-
Диссоциация многоосновных кислот происходит ступенчато:
первая ступень H2S 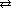 H+ + HS-
H+ + HS-
вторая ступень HS- 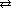 H+ + S2-
H+ + S2-
Из уравнений диссоциации видно, что общим для всех кислот является присутствие в растворе катионов водорода(H+).
На основании этого можно дать определение кислотам с точки зрения Теории электролитической диссоциации:
Кислоты –
это электролиты, при диссоциации которых в качестве катионов образуются только ионы водорода (H+).
Именно катионы водорода являются причиной общих свойств всех кислот: они имеют кислый вкус, изменяют окраску индикаторов, взаимодействуют с металлами, основными оксидами, основаниями.




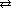 H+ + Cl-
H+ + Cl-


