Реакции ионного обмена
Реакции ионного обмена – это реакции в растворах электролитов, при которых ионы одного вещества обмениваются с ионами другого вещества.
В реакциях ионного обмена наряду с растворимыми сильными электролитами участвуют (образуются или расходуются) нерастворимые вещества, газы, малодиссоциированные соединения (слабые электролиты). Уравнения ионообменных реакций записывают в трех формах: 1) молекулярной 2) полной ионной 3) сокращенной ионной. В качестве примера составим уравнение для реакции между растворами нитрата бария и сульфата натрия. Молекулярное уравнение Ba(NO3)2 + Na2SO4 = BaSO4$ + 2NaNO3 Полное ионное уравнение Ba2+ + 2NO3-+ 2Na+ + SO42- = BaSO4$ + 2Na+ + 2NO3- Сокращенное ионное уравнение Ba2+ + SO42- = BaSO4$
При составлении ионных уравнений сильные растворимые электролиты записывают в виде ионов: катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов). Нерастворимые вещества, газы и слабые электролиты записывают в виде молекул. Внимательно изучите таблицу растворимости – она не только подскажет, какие вещества нерастворимы, но и поможет вам правильно определить заряды катионов и анионов для сильных электролитов. Сокращенное ионное уравнение наиболее ясно выражает сущность реакции. В нашем примере видно, что реакция свелась к образованию нерастворимого вещества (осадка) сульфата бария. Реакции в растворах электролитов практически необратимы и идут до конца в случаях, когда образуется: а) осадок, б) газ, в) слабый электролит.
Примеры уравнений реакций с образованием осадка Взаимодействие растворов кислоты и соли H2SO4 + Pb(NO3)2 = PbSO4$ + 2HNO3 Pb2+ + SO42- = PbSO4$ Взаимодействие растворов сильного основания (щелочи) и соли 2NaOH +MgSO4 = Mg(OH)2$ + Na2SO4 Mg2+ + 2OH- = Mg(OH)2$ Взаимодействие газа (кислотного оксида) с сильным основанием SO2 + Ca(OH)2 = CaSO3$ + H2O SO2 + Ca2+ + 2OH- = CaSO3$ + H2O
Pb(NO3)2 + 2KI = 2KNO3 + PbI2$
Примеры уравнений реакций с образованием газа
Взаимодействие кислоты и соли H2SO4 + K2SO3 = K2SO4 + H2O + SO2# 2H+ + SO32- = H2O + SO2# Взаимодействие сильного основания и соли NaOH + NH4NO3 = NaNO3 + NH3# + H2O NH4+ + OH- = NH3# +H2O
Примеры уравнений реакций с образованием слабого электролита
Реакция нейтрализации 2NaOH + H2SO4 = Na2SO4 + 2H2O OH- + H+ = H2O Взаимодействие нерастворимого основания и кислоты Cu(OH)2 + H2SO4 = CuSO4 + 2H2O Cu(OH)2 + 2H+ = Cu2+ + H2O
Образование слабой кислоты 2NaCH3COO + H2SO4 = Na2SO4 + CH3COOH CH3COO- + H+ = CH3COOH Вопросы для самопроверки 1. Какие реакции называют ионообменными? В каких случаях они идут до конца? 2. В каких формах записывают уравнения РИО? Приведите примеры.
|

 Взаимодействие растворов двух солей (на рисунке)
Взаимодействие растворов двух солей (на рисунке)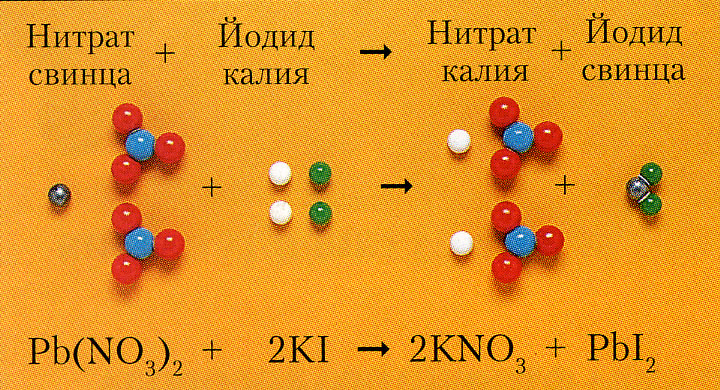 Pb + + 2I- = PbI2$
Pb + + 2I- = PbI2$


