Давление и внутренняя энергия идеального газа
Исторически при изучении макроскопических свойств физических систем сложились два различных подхода – молекулярно-кинетический и термодинамический. Молекулярно-кинетический подход основан на атомно-молекулярных представлениях о строении вещества. Согласно этим представлениям, любое тело – макроскопическая система состоит из огромного ансамбля обособленных одиночных «квазичастиц» индивидуального типа. Молекулярно-кинетический подход или молекулярно-кинетическая теория ставит своей целью истолковать те свойства тел, которые непосредственно наблюдаются на опыте (давление, температура, объём, напряжённость электрического поля…), как суммарный результат действия отдельных частиц. Основываясь на известных динамических законах поведения одиночных «квазичастиц» индивидуального типа и статистическом методе, молекулярно-кинетическая теория устанавливает связь между экспериментально устанавливаемыми макроскопическими величинами, такими как Р, V, Т, Определение состояния системы в статистической физике является гораздо менее детализированным, чем в механике, так как опирается лишь на небольшое число макроскопических параметров. Но поскольку значения макропараметров зависят от движения молекул, задача статистической механики – выразить свойства системы в целом через характеристики отдельных молекул. При этом требуется установить связь макропараметров системы со средними значениями микровеличин и дать способ вычисления этих средних величин на основе законов движения отдельных молекул. Таким образом, макроскопические величины обладают определёнными значениями лишь потому, что они являются средними значениями большого числа элементарных процессов – столкновений упругих и неупругих. Оказалось возможным описывать поведение тел в тепловых явлениях и без детального рассмотрения тех процессов, которые при этом происходят. Такое описание возможно благодаря введению понятий об энергии, её превращениях и способах передачи; установлению тех основных законов, которым подчиняются эти превращения энергии из одних видов в другие. Раздел физики, рассматривающий процессы с энергетической точки зрения, носит название термодинамики. Законы, лежащие в основе термодинамики, носят название начал термодинамики. Эти начала установлены на основании обобщения большой совокупности опытных данных (сверление пушек, добывание огня трением). В силу этого её выводы имеют достаточно общий характер. Являясь наукой феноменологической, термодинамика вводит свои понятия на основе физического эксперимента и поэтому оперирует только макропараметрами. При этом связь между макропараметрами устанавливается опытным путём. Статистическая механика и термодинамика развивались параллельно до тех пор, пока не были доказаны гипотезы об атомно-молекулярном строении вещества и кинетической природе теплоты. С тех пор они слились в единую науку – статистическую термодинамику. Статистическая термодинамика даёт наиболее полное представление о свойствах систем с большим числом частиц. Например, сточки зрения термодинамики температура является величиной, характеризующей направление теплообмена; от тела с более высокой температурой к телу с более низкой температурой. С молекулярно-кинетических представлений аналитическое выражение, Итак, статистическая механика позволяет установить связь между макропараметрами большой системы и средними значениями микровеличин, характеризующими отдельные молекулы. Убедиться в этом проще на модели идеального газа. При описании такой системы как идеальный газ, можно воспользоваться гибкостью понятия частицы. Одним из приёмов здесь является выбор составных частей (объектов) системы. Это позволяет пренебречь внутренним движением в объектах (частях) системы и ограничиться только рассмотрением поступательного хаотического движения объектов. Идеальный газ как макроскопический объект является типичным представителем такой системы. Благодаря тому, что в состоянии теплового равновесия (или вблизи него) взаимодействие между частицами не является интенсивным, удаётся объяснить его свойства на основе описания движения одиночных «квазичастиц» индивидуального типа. Это даёт возможность вычислять макропараметры системы непосредственно из законов динамики системы частиц. Определившись с понятием идеального газа с молекулярной точки зрения, поясним на этой простейшей модели физическую природу давления газа. Допустим, что с площадкой
 выделенного объёма DV успевают долететь и осуществить столкновение с площадкой выделенного объёма DV успевают долететь и осуществить столкновение с площадкой  те частицы, которые находятся в объёме те частицы, которые находятся в объёме 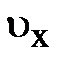 ×D t × ×D t ×  (рис. 5.1., слева). Число этих частиц может быть найдено произведением объёма (рис. 5.1., слева). Число этих частиц может быть найдено произведением объёма 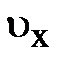 ×D t × ×D t ×  на число частиц на число частиц  , находящихся в единице объёма, т.е. D N = , находящихся в единице объёма, т.е. D N = 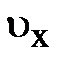 ×D t × ×D t ×  × ×  . Таким образом, полное изменение импульса D К элемента объёма DV в результате столкновения с налетающими на него D N частицами равно произведению импульса . Таким образом, полное изменение импульса D К элемента объёма DV в результате столкновения с налетающими на него D N частицами равно произведению импульса  , переданному объёму DV одной частицей, на число частиц D N, испытавших столкновение с этим элементом объёма; т.е. аналитически изменение импульса D К может быть представлено D К = , переданному объёму DV одной частицей, на число частиц D N, испытавших столкновение с этим элементом объёма; т.е. аналитически изменение импульса D К может быть представлено D К = 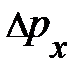 × D N = 2 × D N = 2  × × 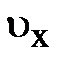 ×D t × ×D t ×  × ×  . Из второго закона Ньютона . Из второго закона Ньютона  следует, изменение импульса DК элемента объёма DV эквивалентно действию на этот элемент дополнительной силы, модуль которой D F = Dр/D t = DК/D t = 2 следует, изменение импульса DК элемента объёма DV эквивалентно действию на этот элемент дополнительной силы, модуль которой D F = Dр/D t = DК/D t = 2  × × 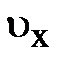 × ×  × ×  . Отнеся полученное выражение силы к площадке . Отнеся полученное выражение силы к площадке  , получим давление газа, оказываемое на элемент DV объёма, , получим давление газа, оказываемое на элемент DV объёма,  2 2  × × 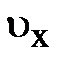 × ×  . .
Здесь остаётся неопределённой, а скорее не уточнённой, величина Итак, на законах сохранения энергии и импульса при упругом столкновении в отсутствие внешнего воздействия, а также на естественных соображениях симметрии движения в условиях теплового равновесия нам удалось получить уравнение давления для идеального газа. Из основного уравнения кинетической теории газов
|

 …, характеризующими систему в целом, и микроскопическими характеристиками системы, такими как
…, характеризующими систему в целом, и микроскопическими характеристиками системы, такими как  ,
,  ,
,  ,
,  , … Отсюда другое название молекулярно-кинетической теории – статистическая физика.
, … Отсюда другое название молекулярно-кинетической теории – статистическая физика. , даёт возможность установить физический смыл макропараметра Т, связав его со средней кинетической энергией хаотического движения; средняя кинетическая энергия молекул не зависит от природы газа, а зависит только от его температуры.
, даёт возможность установить физический смыл макропараметра Т, связав его со средней кинетической энергией хаотического движения; средняя кинетическая энергия молекул не зависит от природы газа, а зависит только от его температуры.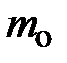 и проекции скорости
и проекции скорости  (рис. 5.1.). Поскольку масса частицы
(рис. 5.1.). Поскольку масса частицы  , по законам упругого столкновения, изменяет направление на противоположное, но его модуль (численное значение) сохраняется. Естественно, при столкновении каждая частица передаёт элементу объёма DV импульс, равный по модулю изменению импульса частицы, т.е. разности векторов импульса после столкновения
, по законам упругого столкновения, изменяет направление на противоположное, но его модуль (численное значение) сохраняется. Естественно, при столкновении каждая частица передаёт элементу объёма DV импульс, равный по модулю изменению импульса частицы, т.е. разности векторов импульса после столкновения  и до столкновения
и до столкновения 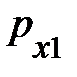 ; аналитически это запишется
; аналитически это запишется  . Учитывая, что соударение сталкивающейся частицы с элементом объёма DV упругое, изменение её импульса
. Учитывая, что соударение сталкивающейся частицы с элементом объёма DV упругое, изменение её импульса  .
.
 . Действительно, выше мы предполагали, что эти частицы, движутся к площадке
. Действительно, выше мы предполагали, что эти частицы, движутся к площадке  . Окончательное выражение для давления газа примет вид p = 2
. Окончательное выражение для давления газа примет вид p = 2 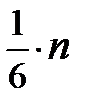 =
=  . Если учесть, что кинетическая энергия одной молекулы
. Если учесть, что кинетическая энергия одной молекулы  , давление газа может быть представлено через энергию частицы
, давление газа может быть представлено через энергию частицы  .
.


