Первое начало термодинамики
Термодинамическая система, как и любая другая физическая система, состоит из большого ансамбля обособленных частиц. Эти частицы совершают бесконечное тепловое движение и взаимодействуют между собой. Следовательно, внутренняя энергия системы есть сумма всех видов кинетической и потенциальной энергии всех составных частей системы: тел, их молекул, атомов, электронов. Таким образом, в состав внутренней энергии входит кинетическая энергия поступательного и вращательного движений атомов и молекул, энергия их колебательного движения, потенциальная энергия взаимодействия атомов и молекул, кинетическая и потенциальная энергия электронов в атомах, внутриядерная энергия. Однако в большинстве физических явлений, в которых участвуют термодинамические системы, не все перечисленные виды энергии испытывают изменения. В частности, внутриатомная энергия в таких процессах не участвует. Поэтому, употребляя понятие внутренней энергии, имеют в виду не полную энергию данной системы, а только ту её часть, которая изменяется в рассматриваемых явлениях. Внутренняя энергия системы является однозначной функцией её состояния. Это означает, в каждом определённом состоянии система обладает вполне определённым значением внутренней энергии; всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от процесса, приведшего систему из одного состояния в другое. Следовательно, при переходе системы из одного состояния в другое изменение её внутренней энергии Внутренняя энергия термодинамической системы может быть рассчитана в зависимости от значений всех физических величин, определяющих это состояние: V, Р, Т и т. д. Для тел, находящихся в твёрдом или жидком состоянии расчёт внутренней энергии затруднён и требует использования упрощающих предположений. Однако имеется довольно простой путь расчёта внутренней энергии для разряжённого газа в зависимости от его температуры. В параграфе 5.1. рассмотрена модель идеального газа; его частицы в среднем находятся далеко друг от друга и слабо взаимодействуют между собой. При этих условиях потенциальной энергией взаимодействия частиц можно пренебречь и тогда внутренняя энергия идеального газа определяется только кинетической энергией теплового движения его частиц. В последнем абзаце параграфа 5.2. показано, кинетическая энергия теплового движения частицы В самом общем случае рассматриваемая термодинамическая система, обмениваясь энергией со средой или окружающими телами, может получать или отдавать количество теплоты Q, может производить работу или над ней может быть произведена работа А. Следовательно, тепло и работа – две формы, в которых энергия системы может передаваться среде или, наоборот, энергия среды может передаваться термодинамической системе. По закону сохранения энергии исключается возможность каких-либо потерь при энергетическом обмене. Естественно, разность энергий термодинамической системы в двух состояниях должна равняться сумме теплоты и работы, полученных системой из окружающей среды:
здесь d А – работа, совершаемая системой над внешними телами, при этом
|

 будет всегда равно разности значений внутренней энергии U1 и U2 в этих состояниях
будет всегда равно разности значений внутренней энергии U1 и U2 в этих состояниях 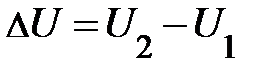 . Однако следует заметить, при данной внутренней энергии система может находиться в различных состояниях.
. Однако следует заметить, при данной внутренней энергии система может находиться в различных состояниях.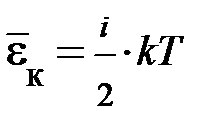 , и аналитическая запись внутренней энергия идеального газа принимает вид: U =
, и аналитическая запись внутренней энергия идеального газа принимает вид: U =  = N ×
= N ×  .
. ; здесь
; здесь  – работа, совершаемая внешними телами над системой; Q – количество сообщённого системе тепла; U1 и U2 – начальное и конечное значения внутренней энергии термодинамической системы. Поскольку внутренняя энергия системы является функцией состояния, прирост энергии при переходе термодинамической системы из одного состояния в другое всегда один и тот же и не зависит от характера или способа перехода от начального состояния к конечному. Если измерять сообщённые системе теплоту и работу в различных переходах от одного и того же начального к одному и тому же конечному состоянию, прирост энергии во всех случаях должен быть одним и тем же. Выраженный в приведённой форме закон сохранения энергии носит название первого начала термодинамики. Аналитическая запись первого начала термодинамики для элементарного процесса имеет вид:
– работа, совершаемая внешними телами над системой; Q – количество сообщённого системе тепла; U1 и U2 – начальное и конечное значения внутренней энергии термодинамической системы. Поскольку внутренняя энергия системы является функцией состояния, прирост энергии при переходе термодинамической системы из одного состояния в другое всегда один и тот же и не зависит от характера или способа перехода от начального состояния к конечному. Если измерять сообщённые системе теплоту и работу в различных переходах от одного и того же начального к одному и тому же конечному состоянию, прирост энергии во всех случаях должен быть одним и тем же. Выраженный в приведённой форме закон сохранения энергии носит название первого начала термодинамики. Аналитическая запись первого начала термодинамики для элементарного процесса имеет вид: (1)
(1) . Из аналитической записи первого начала термодинамики следует, количество тепла Q можно измерять в тех же величинах, что и работу или энергию. Единицей количества теплоты в СИ служит джоуль (Дж).
. Из аналитической записи первого начала термодинамики следует, количество тепла Q можно измерять в тех же величинах, что и работу или энергию. Единицей количества теплоты в СИ служит джоуль (Дж).


