Лабораторна робота № 212 ВИЗНАЧЕННЯ СПІВВІДНОШЕННЯ ТЕПЛОЄМНОСТЕЙ ПОВІТРЯ СP/СV МЕТОДОМ КЛЕМАНА–ДЕЗОРМА
Завдання: експериментально визначити співвідношення теплоєм-ностей повітря за сталого тиску і сталого об’єму СP /СV. Приладдя: установка для визначення співвідношення теплоємностей повітря. Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ізопроцеси в ідеальному газі; адіабатичний процес; рівняння Пуассона; внутрішня енергія ідеального газу; теплоємність, питома та молярна теплоємності; теплоємність за сталого тиску і сталого об’єму; рівняння Майєра; ступені вільності молекул; визначення СP /СV через ступені вільності молекул.
Література: 1) § 16.2–16.5, с. 285–304; 2) § 18.6–18.8, c. 68–74; 3) § 45–46, с. 104–146; § 71–72, с. 223–232; 4) § 41, с. 73–75; § 50–51, с.88–90; § 53,55, с. 94–96.
Опис установки. Експериментальна установка (рис. 13) складається зі скляної посудини 1, герметично закритої корком 5. Через корок проходить скляна трубка з двоходовим краном 4. Кран 4 може з’єднувати посудину 1 з атмосферою або ж із помпою 2, якщо кран 3 відкритий. У першому випадку тиск повітря в балоні дорівнює атмосферному, а різниця рівнів рідини у манометрі 6 – нулю. Якщо кран 4 повернути в інше положення і помпою 2 нагнітати повітря в балон, то тиск у ньому збільшиться на D р = rgh, де r – густина, а h – різниця рівнів рідини в манометрі 6.
Ідея роботи та виведення робочої формули. В цій роботі досліджують процес адіабатичного розширення газу, який описує рівняння Пуассона PVg = const або P 1 - g Tg = const, (1) де g = СP / СV – показник адіабати. Очевидне таке: якщо зв’язок між параметрами двох станів газу Р і Т відомий, то з (1) можна отримати вираз для розрахунку СP / СV. У цій роботі досліджуваним газом є повітря, яке міститься в балоні. Після нагнітання в балон повітря його рівноважний стан визначатимуть такі параметри: V, Т 1 і P 1, де V – об’єм балона; Т 1– кімнатна температура, а Р 1= Р 0+ rgh 1. (2) Тут P 0 – атмосферний тиск; h 1 – різниця рівнів рідини в манометрі. Переведемо повітря в балоні в інший стан, з’єднавши за допомогою крана 4 об’єм балона на короткий проміжок часу з атмосферою. Внаслідок адіабатичного розширення частина повітря вийде з балона. Тиск у балоні буде дорівнювати P 0, а температура знизиться до Т 2. Цей процес описує рівняння (1), а саме:
Після закриття крана 4 повітря в балоні з часом знову нагріється до кімнатної температури Т 1, а тиск у балоні Р 2= Р 0+ rgh 2. (4) Зазначимо, що цей процес є ізохорним, оскільки об’єм повітря в балоні не змінюється, а тому
Параметри T 1 і P 2 визначають третій стан газу. Підставимо (5) у (3), отримаємо
Прологарифмуємо рівняння (6) і розв’яжемо його щодо g:
або, використавши (2) і (4),
Розкладемо логарифми в ряд Тейлора і, обмежившись двома першими членами, матимемо
Підставимо отримані вирази в рівняння (8) і отримаємо
Формула (9) є робочою формулою цієї лабораторної роботи.
|


 . (3)
. (3)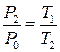 . (5)
. (5) . (6)
. (6)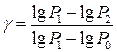 , (7)
, (7)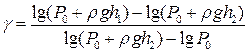 . (8)
. (8) i
i 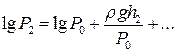
 . (9)
. (9)


