Лабораторна робота № 210. ВИЗНАЧЕННЯ СТАЛОЇ БОЛЬЦМАНА ТА УНІВЕРСАЛЬНОЇ ГАЗОВОЇ СТАЛОЇ
Завдання: визначити експериментально сталу Больцмана й обчислити універсальну газову сталу. Приладдя:установка для визначення сталої Больцмана; рідина, яка легко випаровується за кімнатної температури (діетиловий ефір, етиловий спирт, ацетон); шприц медичний. Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний газ, рівняння Менделєєва–Клапейрона, закони Авогадро і Дальтона, основне рівняння молекулярно-кінетичної теорії, фізичний зміст сталої Больцмана й універсальної газової сталої. Література: 1) § 14.5, c. 241–247; 2) § 13.1–13.2, c. 129–138; 3) § 42–44, с. 129–138; 4) § 41–43, с. 73–78.
Ідея роботи та виведення робочої формули. Визначення сталої Больцмана в цій роботі ґрунтується на використанні рівняння стану ідеального газу Менделєєва–Клапейрона
та співвідношення між універсальною газовою сталою R і сталою Больцмана k R=kNA, (2) де NA = 6,022 •1023 моль-1– число Авогадро.
Як модель ідеального газу в цій роботі використовують пару рідини, яка швидко випаровується за кімнатної температури (наприклад, діетиловий ефір). Якщо порцію ефіру масою m вприснути у закриту посудину об’ємом V 0, то тиск у посудині збільшиться від Р 0 до Р 0 +D Р, де Р 0 – атмосферний тиск, а D Р –парціальний тиск пари ефіру. Стан пари ефіру описує рівняння (1). Тоді з (1) і (2) отримаємо
де m – молекулярна маса ефіру; Т – абсолютна температура. У роботі парціальний тиск пари ефіру вимірюють манометром 6: D P = r 0 gh, (4) де r 0 – густина рідини; h – різниця рівнів рідини в манометрі. Масу ефіру можна обчислити як m = rV, (5) де r – густина, а V – об’єм ефіру, який уводять у посудину. Якщо тепер формули (4) і (5) підставити у (3), то отримаємо вираз для розрахунку сталої Больцмана:
Вирази (6) і (2) є робочими формулами лабораторної роботи.
|

 Опис установки. Експериментальна установка (рис. 11) складається зі скляної посудини 1, закритої корком 2, у який герметично вставлені голка шприца 3 і скляна трубка з кранами 4 і 5. Кран 5 з’єднаний гумовою трубкою з водяним манометром 6.
Опис установки. Експериментальна установка (рис. 11) складається зі скляної посудини 1, закритої корком 2, у який герметично вставлені голка шприца 3 і скляна трубка з кранами 4 і 5. Кран 5 з’єднаний гумовою трубкою з водяним манометром 6. (1)
(1) , (3)
, (3)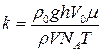 . (6)
. (6)


