Законы фазовых превращений многофазных систем
Нефть и газ в залежи в зависимости от давления Р, температуры Т и состава может находиться в разных агрегатных состояниях. В одних случаях газовая (паровая) фаза полностью растворена в жидкой фазе, а в других – залежь имеет газовую шапку, т.е. над поверхностью жидкой нефти имеются газы, находящиеся в фазовом равновесии с нефтью. Известно, что индивидуальное вещество (метан, этан, углекислый газ и т.д.) может одновременно находиться во всех трех фазах. Чтобы определить или предсказать, в каких именно фазовых состояниях находится то или иное вещество и вся система в целом, можно воспользоваться правилом фаз Гиббса, справедливое для любой системы в состоянии термодинамического равновесия: n-k+2=f, где п— число компонентов; k— число фаз; f —число независимых степеней свободы системы. Под степенями свободы подразумеваются такие независимые переменные, как температура, давление и состав фаз. Так, индивидуальные вещества, находящиеся в двухфазном состоянии (например, пар и жидкость), имеют одну степень свободы (n=1; k+2; f=1). Для определения всех свойств фаз достаточно задаться одним лишь значением температуры. Индивидуальные вещества, находящиеся в трехфазном состоянии, не имеют степеней свободы (это состояние выражается тройной точкой на соответствующей диаграмме). Двухкомпонентные системы, находящиеся в двухфазном состоянии, имеют две степени свободы, т. е. состояние такой системы будет определяться температурой и давлением. Если в двухфазном состоянии находится трехкомпонентная система, то число степеней свободы будет равно 3. Состояние такой системы определяется температурой, давлением и каким-либо параметром, выражающим состав фаз, например концентрацией одного компонента в какой-либо фазе или отношением концентрации одного компонента к концентрации другого в той же фазе. Фазовое равновесие каждого углеводородного компонента многокомпонентной смеси характеризуется уравнением: y =kx, где y - мольная концентрация данного компонента в паровой фазе, x - мольная концентрация этого компонента в жидкой фазе, k - константа фазового равновесия. Константа равновесия определяется экспериментально, т.к. при большом числе компонентов расчеты их весьма сложны. Однако обычно можно ограничиться учетом основных углеводородных компонентов в данной залежи и, зная давление и температуру, установить расчетным путем, в каком фазовом состоянии находится смесь (и, например, на основе этого сделать вывод о высоте газовой шапки, предсказать ее изменение при изменении термодинамических параметров, т.е. изменении фазового состояния). В общем виде зависимость температуры фазового перехода от давления дается уравнением Клаузиуса-Клапейрона:
где Т и Q – соответственно температура и теплота фазового перехода; Растворение данного газообразного компонента в жидкости будет происходить до тех пор, пока парциальное давление его в газовой фазе не сравнится с парциальным давлением в жидкости (закон Рауля), т.е. Р1=xР2, где Р1 – парциальное давление газообразного компонента, растворенного в жидкости; Р2 – давление насыщенных паров этого компонента при данной температуре; x - мольная концентрация данного компонента в жидкости. При установившемся равновесии фаз парциальные давления каждого компонента в газовой и жидкой фазах равны. Константа фазового равновесия зависит от давления и температуры: с повышением температуры растворимость газа уменьшается, и, следовательно, снижается мольная концентрация его в жидкой фазе. Для прогнозирования фазовых превращений углеводородов используют приближенные (идеализированные) расчеты, в основе которых лежит закон Дальтона-Рауля
где P – общее давление смеси; yi - молярная концентрация компонентов в газовой фазе; Qi – давление насыщенных паров компонентов в чистом виде; х i – молярная концентрация компонентов в жидкой фазе. Причем, очевидно, что Pyi –парциальное давление i-го компонента в паровой фазе; Qiхi – парциальное давление того же компонента в жидкой фазе.
|

 ,
,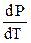 - производная, которая показывает наклон кривой на фазовой диаграмме в координатах «Р – Т»; DV – изменение объема системы в результате фазового перехода.
- производная, которая показывает наклон кривой на фазовой диаграмме в координатах «Р – Т»; DV – изменение объема системы в результате фазового перехода. ,
,


