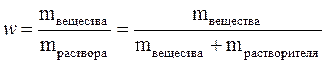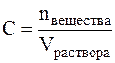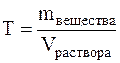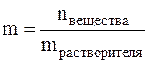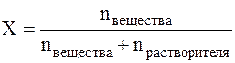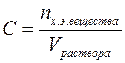Способы выражения состава растворов
Состав любого раствора может быть выражен как качественно, так и количественно. Обычно, при качественной оценке раствора применяют такие понятия как, насыщенный, ненасыщенный, пересыщенный (или перенасыщенный), концентрированный и разбавленный раствор. Насыщенным называется раствор, в котором содержится максимально возможное при данных условиях (t, р) количество растворённого вещества. Насыщенный раствор часто находится в состоянии динамического равновесия с избытком растворённого вещества, при котором процесс растворения и процесс кристаллизации (выпадения вещества из раствора) протекают с одинаковой скоростью. Для приготовления насыщенного раствора растворение вещества необходимо вести до образования осадка, не исчезающего при длительном хранении. Ненасыщенным называется раствор, который содержит вещества меньше, чем его может раствориться при данных условиях. Перенасыщенные растворы содержат в себе по массе больше растворённого вещества, чем его может раствориться в данных условиях. Образуются перенасыщенные растворы при быстром охлаждении насыщенных растворов. Они неустойчивы и могут существовать ограниченное время. Очень быстро лишнее растворённое вещество выпадает в осадок, а раствор превращается в насыщенный. Следует отметить, что при изменении температуры насыщенный и ненасыщенный растворы могут легко обратимо превращаться друг в друга. Процесс выделения твёрдого вещества из насыщенного раствора при понижении температуры называется кристаллизацией. Кристаллизация и растворение играют огромную роль в природе: приводят к образованию минералов, имеют большое значение в атмосферных и почвенных явлениях. На основе кристаллизации в химии распространён метод очистки веществ, который называется перекристаллизацией. Для приблизительного количественного выражения состава раствора используют понятия концентрированный и разбавленный растворы. Концентрированным называется раствор, в котором масса растворённого вещества соизмерима с массой растворителя, т.е. не отличается от него более чем в 10 раз. Если же масса растворённого вещества более чем в десять раз меньше массы растворителя, то такие растворы называются разбавленными. Однако следует помнить, что деление растворов на концентрированные и разбавленные условно, и чёткой границы между ними нет. Точный количественный состав растворов выражают при помощи массовой доли растворённого вещества, его молярной концентрации, а также некоторыми другими способами. Массовая доля растворённого вещества (w) – это безразмерная физическая величина, равная отношению массы растворённого вещества к общей массе раствора, т.е.
Обычно выражается в долях единицы или в процентах. Массовая доля, выраженная в %, называется процентной концентрацией. Она показывает, какая масса вещества растворена в 100 г раствора. Молярная концентрация (С) или молярность – это величина, равная отношению количества растворённого вещества к объему раствора (в литрах), т.е.
Молярность измеряется в моль/л и показывает сколько моль вещества растворено в одном литре раствора. Молярность обозначается обычно буквой М. Если в одном литре раствора содержится 1 моль вещества, то такой раствор называется одномолярным (1М), если 0,1 моль вещества – децимолярным (0,1М), если 0,01 моль вещества – сантимолярным (0,01М), если 0,001 моль вещества – миллимолярным (0,001М). Титром (Т) называется отношение массы вещества в граммах к объёму раствора в мл, т.е.
Титр имеет размерность г/мл, он показывает, сколько грамм вещества растворено в 1 мл раствора. Моляльная концентрация или моляльность (m) – это величина, равная отношению количества растворённого вещества к массе растворителя, выраженной в кг, т.е.
Моляльность имеет размерность моль/кг и показывает, какое количество вещества растворено в 1 кг растворителя. Мольная доля (Х) – это величина, равная отношению количества растворённого вещества к общему количеству вещества в растворе:
Мольная доля – это безразмерная величина и измеряется в долях единицы или в %. Молярная концентрация химического эквивалента вещества (С) или нормальная концентрация – это величина, равная отношению количества химического эквивалента растворённого вещества к объему раствора (в литрах), т.е.
Молярная концентрация химического эквивалента вещества измеряется в моль/л и показывает сколько моль эквивалента вещества растворено в одном литре раствора. Она обозначается обычно буквой н. Если в одном литре раствора содержится 1 моль химического эквивалентавещества, то такой раствор называется однонормальным (1н), если 0,1 моль вещества – децинормальным (0,1н), если 0,01 моль вещества – сантинормальным (0,01н), если 0,001 моль вещества – миллинормальным (0,001н).
|