Краткая теория. В 1911 г. Резерфордом была предложена ядерная (планетарная) модель строения атома
В 1911 г. Резерфордом была предложена ядерная (планетарная) модель строения атома. По этой модели весь положительный заряд и почти вся масса (>99,94 %) атома сосредоточены в ядре, размеры которого имеют порядок I0-13 cм. Вокруг ядра по замкнутым орбитам вращаются электроны, образуя электронную оболочку атома. Число электронов в атоме должно равняться числу положительных зарядов атома. Если в атоме есть Z электронов (порядковый номер элемента в периодической системе Менделеева), то атомное ядро должно иметь заряд + Z | l |, где l - заряд электрона. Однако модель атома Резерфорда имела свои недостатки и совершенно не согласовывалась с законами классической электродинамики. Согласно этим законам, всякий электрический заряд, вращаясь по орбите, т.е. двигаясь с ускорением, должен непрерывно излучать электромагнитные волны. Излучение, вызванное вращением электронов вокруг ядра, должно непрерывно отбирать энергию от атома, в силу чего электроны будут приближаться к ядру. С приближением к ядру периодих обращения, а значит и частота излучения, должны непрерывно изменяться. Таким образом, по этим законам спектр излучения атома должен быть сплошным, а на самом деле излучение атомов имеет линейчатый спектр. К тому же, вследствие непрерывной потери энергии, электроны должны упасть на ядро, и поэтому атом как планетарная система не может долго существовать. В действительности атом является очень устойчивой системой. Эти недостатки ядерной модели Резерфорда отметил Бор, который в 1913 г., основываясь на гипотезе Планка о квантовом характере излучения и поглощении света, сформулировал законы движения электронов в атоме в виде постулатов: 1. Электроны в атоме могут находиться только в некоторых определенных устойчивых состояниях, т.е. могут двигаться не по любым орбитам, а только по орбитам вполне определенного радиуса, которые называются стационарными. 2. Из всех возможных состояний в атоме осуществляются только те, для которых момент импульса движения равен целому кратному от h/2π; (условие квантования радиуса орбит), т.е.
где m - масса электрона, v - его скорость, r - радиус орбиты, n - главное квантовое число (n =1,2,3,...), оно определяет номер орбиты, на которой находится электрон, h - постоянная Планка. 3. Переход электрона с одной стационарной орбиты на другую сопровождается излучением (или поглощением) кванта энергии. Величина кванта энергии hν; равна разности энергий электрона в исходном состоянии Е1 и в конечном состоянии Е2: h ν=Е1 – Е2 , (2) где ν; - частота вращения электрона, которая равна частоте излученной (или поглощенной) электромагнитной волны. Соотношение (2) называется условием частот Бора. Рассмотрим с точки зрения теории Бора происхождение спектра атома водорода - простейшего атома, состоящего из положительно заряженного ядра (протона) и одного электрона (Z =1). Масса электрона составляет всего лишь 1/1836 массы протона, поэтому можно считать, что электрон вращается вокруг почти неподвижного ядра. Бор считал, что движение электрона происходит по круговой орбите под действием кулоновской силы притяжения электрона к ядру, обусловливающей центростремительное ускорение. Тогда, воспользовавшись классическим вторым законом динамики, можно записать уравнение движения электрона в виде
где ε0 - электрическая постоянная, равная 8,85*10-12 Кл2/Н*м2. Решая совместно уравнения (I) и (3), можно найти радиусы стационарных орбит атома водорода и скорость движения электрона на n -й орбите:
Из формул (4) следует, что радиусы электронных орбит увеличиваются по мере удаления от ядра как квадраты чисел натурального ряда, а скорости движения электронов на них убывают обратно пропорционально номеру орбиты. Полная энергия атома водорода состоит из потенциальной энергии Eпот взаимодействия между ядром и электроном и кинетической энергии Екин движения электрона по орбите. Величину потенциальной энергии можно рассчитать, с учетом того, что работа электрической силы притяжения при удалении электрона с расстояния r до ∞ равна изменению потенциальной энергии с обратным знаком. Следовательно,
Полная энергия атома водорода будет равна
Подставляя в (7) значение r из (4), получим
Из формулы (8) следует, что энергия атома возрастает c увеличением квантового числа n или, что то же, с увеличением радиуса электронной орбиты. Здесь надо учитывать, что энергия Е отрицательна, поэтому уменьшение ее абсолютного значения соответствует возрастанию энергии. Минимумом энергии атом обладает при движении электрона по ближайшей к ядру орбите (n = 1), а максимумом энергии (Е = 0) - при движении электрона по самой дальней орбите (n = ∞), что соответствует ионизированному атому. Величина полной энергии электрона, находящегося на стационарной орбите, называется уровнем энергии атома. При переходе электрона c одной стационарной орбиты на другую излучается (поглощается) квант анергии, равный разности энергетических уровней атома до излучения (поглощения) и после него. Таким образом, атом может излучать и поглощать электромагнитные волны только вполне определенных частот (длин волн), чем и обусловлен линейчатый характер водородного спектра. Нормальным состоянием атома является такое, при котором электрон движется по самой близкой к ядру орбите (n =1). В этом случае атом не может излучать, поскольку электрон не имеет возможности перейти с этой орбиты еще ближе к ядру. Энергетический уровень, соответствующий этому состоянию, называется нормальным уровнем, а вcе остальные уровни называются возбужденными. Для того, чтобы найти общую формулу для частоты ν излучения атома водорода при переходе электрона с внешней орбиты n2 на внутреннюю орбиту n1, подставим выражение (8) в условие частот (2) и получаем:
Постоянный множитель в правой части
называется постоянной Ридберга. Тогда окончательно для атома водорода имеем:
Здесь n1 = 1,2,3,4,5,... n2 =(n1 +1) и т.д. Когда n1 =1, n2 = 2, 3, 4, 5,..., когда n1 = 2, n2 = 3, 4, 5, 6,... и т.д. Отсюда следует, что все линии спектра атома водорода могут быть объединены в серии, которые описываются формулой (10), если n = const. Серией линий называется совокупность линий, которая возникает при переходе электронов с вышележащих орбит на одну определенную орбиту с данным квантовым числом n1. Для водорода основными сериями являются: серия Лаймана (n1 = 1), серия Бальмера (n1 = 2), серия Пашена (n1 = 3). Образование этих опектральных серий схематически показано на рис.1. Серия Лаймана расположена в далеком ультрафиолете. В видимой части спектра находится серия Бальмера, в инфракрасной области спектра лежит серия Пашена. Видимая часть линейчатого спектра атома водорода (серия Бальмера) состоит из четырех линий, получивших специальные обозначения: красная - Нα (n2=3), зелено-голубая - Hβ (n2 =4), фиолетово-синяя - Нγ (n2 =5), фиолетовая - Нδ (n2 =6). Эти линии получаются при переходе возбужденных электронов с третьей, четвертой, пятой и шестой орбит на вторую, с квантовым числом n1 = 2 (рис. 1).
Самопроизвольный переход электрона на более далекую орбиту, т.е. самопроизвольный переход атома на более высокий энергетический уровень, невозможен. Для осуществления такого перехода необходимо сообщить атому определенное количество энергии извне, т.е. возбудить атом. В газоразрядной водородной (и любой другой) трубке для возбуждения электронов (для их перехода на более высокий уровень) используется электрическая энергия.
Таким образом, теория Бора успешно объяснила строение спектра атома водорода. Рассмотренная теория применима и к водородоподобным атомам, т.е. ионизированным атомам, содержащим только один электрон (например, к ионамHe+, Li++, Be+++). В этом случае формула Бора для серий линий имеет вид
где Z – порядковый номер элемента. Хотя непосредственное использование теории Бора для расчета спектров многоэлектронных атомов оказалось невозможным, она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
|

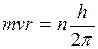 , (1)
, (1)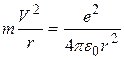 , (3)
, (3)
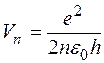 (4)
(4)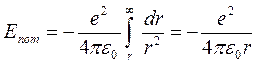 (5)
(5)  (6)
(6) (7)
(7) (8)
(8)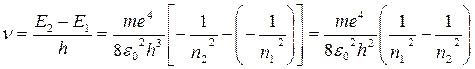 .
. (9)
(9)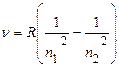 . (10)
. (10) Так как газ состоит из множества различно возбужденных атомов, то в нем одновременно совершаются все возможные типы переходов электронов. Поэтому в спектре излучения водорода одновременно представлены линии всех серий.
Так как газ состоит из множества различно возбужденных атомов, то в нем одновременно совершаются все возможные типы переходов электронов. Поэтому в спектре излучения водорода одновременно представлены линии всех серий.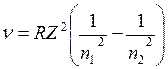 , (11)
, (11)


