ВПГ-1 и ВПГ-2
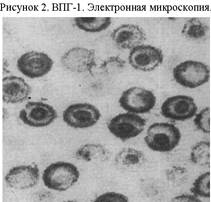
История открытия. Впервые выделены В. Грютером в 1912 г. В 1919 г. А. Левенштейн повторно воспроизвел экспериментальную герпетическую инфекцию на кроликах. В 1921 г. Б. Липшютц описал видимые в световой микроскоп ацидофильные внутриядерные включения. Особенности вирусов. Вирионы имеют диаметр 110-120 нм (рис. 1). Гомологичность последовательностей геномов ВПГ-1 и ВПГ-2 составляет 40-50 %. Геном кодирует более 50 полипептидов, включая минимум 9 гликопротеинов (А, B, C, D, E, F, G, H, I), 6 капсидных протеинов, вирусную протеинкиназу, ДНК-полимеразу, другие ферменты и ДНК-связывающие белки, участвующие в репликации. Гликопротеины суперкапсида являются типоспецифическими антигенами, белки нуклеокапсида – группоспецифическими. Гликопротеины В и D являются основными антигенами и участвуют в прикреплении вируса к клетке; гликопротеин С связывает С3b-рецептор комплемента на клеточной поверхности; гликопротеины В, D и Н нарушают движение адсорбированного вируса с поверхности в цитоплазму клетки.
В связи с тем, что ВПГ поражают даже неделящиеся клетки, способны персистировать, а их геном может принимать большой объем чужеродной ДНК, ВПГ-1 используется в качестве вектора. Резистентность. Инактивируются при температуре выше 60˚С, жирорастворителями, рН<4; выдерживают температуру -256˚С в течение 20,5 ч. При 37˚С сохраняют жизнеспособность в течение 10 ч. Культивирование. Культивируются в куриных эмбрионах на хорион-аллантоисной оболочке, где через 2-3 суток от момента заражения Эпидемиология. ВПГ-1 инфицировано 70-90 % людей, а ВПГ-2 – 15-50 %. Первичное инфицирование происходит в раннем возрасте, после исчезновения материнских антител. Источником инфекции являются больные люди и вирусоносители. Механизм передачи – перкутанный. Пути передачи для ВПГ-1 – контактно-бытовой (через слюну, посуду, губную помаду), для ВПГ-2 – половой, а также интранатальный (при прохождении плода через инфицированные родовые пути). При ВПГ-1-инфекции возможно трансплацентарное инфицирование плода. Патогенез. Вирусы инфицируют эпителий слизистой оболочки рта, глотки или половых органов, где происходит их первичная репликация, которая сопровождается гибелью клеток с образованием везикул. Дальнейшее распространение герпесвирусов в организме человека происходит по чувствительным нервам, по лимфатическим и реже – кровеносным сосудам. Важными вторичными клетками-мишенями для герпесвирусов являются нейроны тройничного узла и спинномозговых ганглиев, головного мозга и клетки менингеальных оболочек. При генерализации инфекции у иммуноскомпрометированных лиц (больные СПИДом, опухолями, реципиенты донорских органов) возникает вирусемия с диссеминацией герпесвирусов во множество органов и развитием менингоэнцефалита, пневмонии, гепатита, коагулопатий. Выздоровление при первичном инфицировании сопровождается латентной формой персистенции герпесвирусов в нервных ганглиях с почти полным иммунитетом от реинфицирования гомологичным типом и частичным иммунитетом от гетерологичного типа. Рецидивы латентной инфекции развиваются у части инфицированных в результате переохлаждения, избыточной инсоляции, стрессовых ситуаций и пр. Из нервных ганглиев герпесвирусы по центробежным нейронам достигают нервных окончаний, откуда проникают в эндотелий капилляров кожи и эпителиальные клетки. В них происходит репродукция герпесвирусов, что сопровождается возникновением эритематозных везикулопапул диаметром 1-2 мм. Везикулярная жидкость содержит большое количество вирионов. Через несколько дней везикулы подсыхают с образованием корочек, отпадающих без формирования рубцов. ВПГ-1 способен индуцировать апоптоз в активированных лимфоцитах периферической крови, особенно в Т-хелперах, но не в Т-супрессорах. Это может лежать в основе иммуносупрессии и лимфоцитопении при ВПГ-1-инфекции. ВПГ-2 способен трансформировать нормальные эндотелиоциты в опухолевые. Клиника. ВПГ-1 чаще вызывает инфекции ротоой полости и близлежащих тканей, ВПГ-2 – инфекции половой системы (табл. 1). Классическим проявлением ВПГ-1-инфекции является герпетический гингивостоматит, проявляющийся обширными болезненными везикулярными поражениями слизистой оболочки полости рта и сопровождающийся высокой температурой и увеличением подчелюстных лимфоузлов. Другими клиническими проявлениями ВПГ-1-инфекции являются конъюнктивит и кератит. Наиболее серьезной инфекцией, вызванной ВПГ-1, является спорадический энцефалит, уровень смертности при котором составляет 70 %. Классическим проявлением первичной ВПГ-2-инфекции является генитальный герпес, который характеризуется двусторонними множественными поражениями кожи и слизистых оболочек половых органов, сопровождающимися повышением температуры тела, увеличением паховых лимфоузлов и дизурией. Манифестная ВПГ-инфекция в 85 % случаев вызывается ВПГ-2, в 15 % - ВПГ-1. В 99 % случаев генитальный герпес, вызванный ВПГ-2, рецидивирует. Наиболее опасным последствием генитального герпеса является инфицирование новорожденных. Иммунитет. Естественный пассивный иммунитет против ВПГ-1 и ВПГ-2 обеспечивается антителами матери в течение первого полугода жизни. Наибольшая восприимчивость к герпетической инфекции у детей отмечается в возрасте до 2 лет. Приобретенный активный иммунитет не является стерильным и обеспечивается преимущественно специфическими секреторными Ig А. Наличие в организме антител и антигенспецифических Т-киллеров не препятствует персистенции герпесвирусов. Лабораторная диагностика. Применяются вирусоскопический, вирусологический и серологический методы. Материалом для исследования служат соскобы с роговой оболочки, содержимое везикул, слюна, кровь, спинномозговая жидкость. Вирусоскопический метод с использованием световой микроскопии заключается в приготовлении мазков из свежих герпетических высыпаний, окрашивании их по Романовскому-Гимзе и выявлении многоядерных клеток, содержащих ацидофильные внутриядерные включения (тельца Липшютца). Люминесцентная микроскопия проводится с использованием иммунных противогерпетических сывороток. Вирусологический метод включает выделение герпесвирусов в культурах клеток, куриных эмбрионах или на лабораторных животных (мыши, кролики). При культивировании на хорион-аллантоисной оболочке куриных эмбрионов ВПГ-2 образует более крупные бляшки, чем ВПГ-1. Индикацию вирусов проводят по ЦПД, идентификацию – в реакции нейтрализации на животных, куриных эмбрионах или клеточных культурах с использованием стандартных противогерпетических иммунных сывороток. Серологический метод включает использование РСК и ИФА. Наличие в исследуемой сыворотке специфических Ig М свидетельствует об острой первичной инфекции, наличие Ig G – об обострении хронической инфекции. Лечение. Используются: 1) химиопрепараты-ингибиторы вирусных ферментов: ацикловир (зовиракс) – ингибитор рибонуклеотидной редуктазы; аденинарабинозид – ингибитор синтеза ДНК, фосковир – ингибитор ДНК-полимеразы; 2) α-интерфероны; 3) индукторы продукции эндогенного интерферона. Интерферон и его индукторы наиболее эффективны в репродуктивном цикле герпесвирусной инфекции. В тяжелых случаях, а также при частых рецидивах, для лечения герпесвирусной инфекции используют убитую культуральную герпетическую вакцину. Резистентные к химиотерапии вирусы образуются в результате мутаций генов, кодирующих тимидинкиназу или ДНК-полимеразу. Профилактика. Неспецифическая профилактика включает противоэпидемические мероприятия, применяемые при ликвидации инфекций наружных покровов (см. главу «Эпидемиология вирусных инфекций»). При риске интранатального заражения плода показано проведение операции кесарева сечения. В США разработаны и используются в течение последних 15 лет генно-инженерные и субъединичные герпесные вакцины, полученные из ВПГ-1 и ВПГ-2. Разработана также живая генно-инженерная вакцина, состоящая из ВПГ-2, у которых делетированы онкогены, а сам вирусный штамм ослаблен при выращивании на культурах клеток.
|

 Особенностью генома ВПГ-2 является то, что 5-конец гена RR1(онкоген ВПГ-2) кодирует активность протеинкиназы, отвечающей за неопластический потенциал этого вируса. ДНК-последовательности ВПГ-2 имеют бессмертные и неопластические функции. Трансформированные клетки человека вызывают опухоли, которые экспрессируют вирусный онкопротеин, когда их вводят атимическим мышам. Мутации, которые инактивируют протеинкиназную активность онкопротеина, уменьшают неопластический потенциал, а клеточная пролиферация и рост опухоли ингибируются «бессмысленными» олигонуклеотидами, которые угнетают синтез онкопротеинов. У протеинкиназы RR1 ВПГ-1 нет онкогенного потенциала. Однако ВПГ-1 вызывает мутагенез и амплификацию генов, активирует клеточные гены и вызывает морфологическую трансформацию. Мутации в онкогене могут его как активировать, так и инактивировать. К инактивации онкогена приводит также образование нечитаемых участков олигонуклеотидов в онкогене. Ранний белок IPC47 регулирует специфический иммунитет к герпесвирусам путем интерференции с презентацией антигена Т-цитотоксикам.
Особенностью генома ВПГ-2 является то, что 5-конец гена RR1(онкоген ВПГ-2) кодирует активность протеинкиназы, отвечающей за неопластический потенциал этого вируса. ДНК-последовательности ВПГ-2 имеют бессмертные и неопластические функции. Трансформированные клетки человека вызывают опухоли, которые экспрессируют вирусный онкопротеин, когда их вводят атимическим мышам. Мутации, которые инактивируют протеинкиназную активность онкопротеина, уменьшают неопластический потенциал, а клеточная пролиферация и рост опухоли ингибируются «бессмысленными» олигонуклеотидами, которые угнетают синтез онкопротеинов. У протеинкиназы RR1 ВПГ-1 нет онкогенного потенциала. Однако ВПГ-1 вызывает мутагенез и амплификацию генов, активирует клеточные гены и вызывает морфологическую трансформацию. Мутации в онкогене могут его как активировать, так и инактивировать. К инактивации онкогена приводит также образование нечитаемых участков олигонуклеотидов в онкогене. Ранний белок IPC47 регулирует специфический иммунитет к герпесвирусам путем интерференции с презентацией антигена Т-цитотоксикам.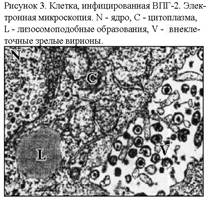 образуют белые выпуклые бляшки, видимые невооруженным глазом. Хорошо размножаются во всех типах клеточных культур. ЦПД проявляется в образовании гигантских многоядерных клеток, внутриядерных телец-включений, лизисом клеток (рис. 3). К герпесвирусам чувствительны мыши, крысы, морские свинки, хомяки, кролики, кошки, собаки, обезьяны, птицы.
образуют белые выпуклые бляшки, видимые невооруженным глазом. Хорошо размножаются во всех типах клеточных культур. ЦПД проявляется в образовании гигантских многоядерных клеток, внутриядерных телец-включений, лизисом клеток (рис. 3). К герпесвирусам чувствительны мыши, крысы, морские свинки, хомяки, кролики, кошки, собаки, обезьяны, птицы.


