Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ.
Степень окисления атома любого элемента в свободном состоянии равна нулю. Степень окисления любого простого одноатомного иона равна его заряду. 3) Степень окисления водорода в его соединениях с другими элементами равна +1. 4) Степень окисления кислорода равна -2 во всех соединениях, где кислород не образует простой ковалентной связи О—О. Положительную степень окисления Оксиген проявляет только в соединениях с Флуором (например, в соединении OF2, где степень окисления Оксигена равна +2). Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю. Если в ходе химической реакции степень окисления атома повышается, то говорят, что он ОКИСЛЯЕТСЯ. Если же степень окисления понижается, то говорят, что он ВОССТАНАВЛИВАЕТСЯ. Просто так трудно запомнить, какой процесс – отдачи или захвата электронов – называется окислением, а какой – восстановлением. Какой атом приобретает отрицательную, а какой – положительную степень окисления.
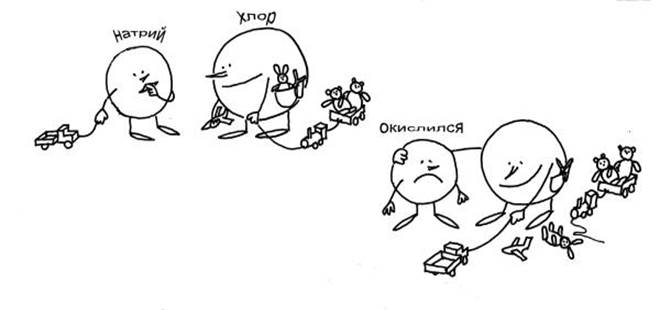
Не совсем обычная запись уравнения химической реакции: Na + Cl = NaCl Хлор – "отрицательный", он отбирает чужие электроны. Натрий "окислился"– это заметно по его кислой физиономии. Рисунок рассказывает о реакции между натрием и хлором так, как будто это случилось в "химическом детском саду". В этом “детском саду” порядки такие же, как и в обычном. У Хлора целых 7 игрушек (электронов). Натрию же достался только грузовичок (1 электрон). Тут Хлор увидел у Натрия грузовичок и решил, что именно этой игрушки ему и не хватает! Хлор посильнее, поэтому грузовичок мгновенно оказался у него. А чтобы Натрий не ябедничал (у него такой окислившийся вид!), Хлор предложил поиграть вместе. Какое там! Конечно же, все 8 игрушек Хлор подтащил поближе к себе, а Натрию только и остается, что стоять рядом с “окисленным” видом. Итак, какова мораль? Хлор, конечно, отрицательный. Он отобрал чужую игрушку-электрон. Теперь у него отрицательная степень окисления. Натрий, безусловно, окислился – вон какой у него “кислый” вид. Но и от Хлора не отходит – игрушек-то больше нет! Чем не картина образования химической связи в типичной окислительно-восстановительной реакции? Остается только добавить, что восстанавливается в таких реакциях окислитель, а окисляется – восстановитель. В нашей истории хлор – окислитель, а натрий – восстановитель. Точно так же реагирует с хлором-окислителем металлический калий (восстановитель). У калия еще легче "отобрать" электрон, чем у натрия, поскольку его внешняя электронная оболочка находится дальше от ядра. Реакция протекает с выделением белого "дыма" - кристаллов соли KCl. Максимальная положительная степень окисления элемента обычно совпадает с номером его группы в периодической системе. Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления – минус восемь. Исключение составляют флуор, оксиген, феррум: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе. Понятие степени окисления введено в предположении о полном смещении пар электронов к тому или другому атому (показывая при этом заряд ионов, образующих ионное соединение). Поэтому следует помнить, что в полярных соединениях степень окисления означает число электронов, лишь смещенных от данного атома к атому, связанному с ним. Совсем формальным понятие степени окисления становится, когда оно используется при рассмотрении ковалентного соединения. Различие между понятием степени окисления и валентности в ковалентных соединениях наглядно можно проиллюстрировать на хлорпроизводных метана: валентность Карбона везде равна четырем, а степень окисления его (считая степени окисления Гидрогена + 1 и хлора – 1 во всех соединениях) в каждом соединении разная: -4 -2 0 +2 +4 1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na0, H02, P04. 2) Необходимо запомнить элементы, для которых характерны неизменные степени окисления. Все они перечислены в таблице.
3) Поиск степеней окисления остальных элементов основан на простом правиле: В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона. Рассмотрим применение этого правила на простых примерах. Пример 1. Необходимо найти степени окисления элементов в аммиаке (NH3). Решение. Мы уже знаем (см. 2), что ст. ок. Гидрогена равна +1. Осталось найти эту характеристику для Нитрогена. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3*(+1) = 0. Решение очевидно: х = -3. Ответ: N-3H3+1.
Пример 2. Укажите степени окисления всех атомов в молекуле H2SO4. Решение. Степени окисления Гидрогена и Оксигена уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления Сульфура: 2*(+1) + х + 4*(-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H+12S+6O-24.
Пример 3. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3. Решение. Алгоритм остается неизменным. В состав "молекулы" алюминий нитрата входит один атом Al(+3), 9 атомов Оксигена (-2) и 3 атома Нитрогена, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1*(+3) + 3х + 9*(-2) = 0. Ответ: Al+3(N+5O-23)3.
Пример 4. Определите степени окисления всех атомов в ионе (AsO4)3-. Решение. В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4*(-2) = -3. Ответ: As(+5), O(-2).
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение! Пример 5. Определите степени окисления всех элементов в (NH4)2SO4. Решение. Степени окисления Гидрогена и Оксигена известны, Сульфура и Нитрогена – нет. Классический пример задачи с двумя неизвестными! Будем рассматривать аммоний сульфат не как единую "молекулу", а как объединение двух ионов: NH4+ и SO42-. Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления Нитрогена и Сульфура. Ответ: (N-3H4+1)2S+6O4-2. Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Пример 6. Укажите степени окисления всех элементов в CH3CH2OH. Решение. Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома Карбона. Рассуждать можно следующим образом. Рассмотрим, например, атом Карбона в составе метильной группы. Данный атом С соединен с 3 атомами Гидрогена и соседним атомом Карбона. По связи С-Н происходит смещение электронной плотности в сторону атома Карбона (т. к. электроотрицательность С превосходит ЭО Гидрогена). Если бы это смещение было полным, атом Карбона приобрел бы заряд -3. Атом С в составе группы -СН2ОН связан с двумя атомами Гидрогена (смещение электронной плотности в сторону С), одним атомом Оксигена (смещение электронной плотности в сторону О) и одним атомом Карбона (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления Карбона равна -2 +1 +0 = -1. Ответ: С-3H+13C-1H+12O-2H+1.
|