Кинетика твердофазовых реакций
В связи с тем, что твердофазовое взаимодействие протекает стадийно, на каждой стадии (кинетической, диффузионной или переходной) суммарная скорость процесса будет контролироваться законами химической либо диффузионной кинетики. Следовательно, общее уравнение, описывающее такой процесс в целом без ряда допущений, написать не возможно. Одной из первых формул, описывающих кинетику твердофазовых реакций, является уравнение Яндера, выведенное исходя из закона Фика, увязывающего количество вещества, диффундирующего за единицу времени через единицу площади, перпендикулярной направлению диффузии, пропорционально градиенту концентраций. Для твердофазовой реакции, скорость которой лимитируется диффузией для изотермических условий, уравнение Яндера имеет вид
где х - толщина слоя продукта реакции на покрываемом менее подвижном компоненте; t - время; D - коэффициент диффузии при данной температуре; С 0 - концентрация диффундирующего компонента на границе со слоем продукта реакции. Поскольку измерить толщину слоя продукта реакции практически очень трудно, особенно в порошкообразных смесях, эту величину можно выразить через степень химического превращения компонента, что достаточно легко определить методами количественного анализа, и тогда уравнение приобретает вид:
где у - степень превращения покрываемого компонента, т. е. его количество, вошедшее в реакцию, мас. %; К¢ - постоянная. Если график построенный в координатах Поскольку при выводе этого уравнения, был сделан ряд допущений (плоский слой продуктов реакции), то оно оказывается пригодным для описания лишь начальных стадий реакций, т. е. при 10-40% степени превращения. В последующем А. М. Гинстлинг и Б. И. Бройнштейн предложили уравнение кинетики твердофазовых реакций, учитывающее сферичность реагирующих частиц в смеси для изотермического процесса:
где G - степень превращения покрываемого компонента в долях единицы; t - время; К¢¢ - постоянная. Последнее уравнение более корректно описывает кинетику, особенно при больших степенях превращения компонентов и больших значениях t, чем уравнение Яндера. В связи с тем, что в твердофазовых реакциях реагенты находятся в активном состоянии и характеризуются высокой концентрацией неравновесных дефектов, подвижность составных частей кристаллической решетки оказывается значительно выше, чем в равновесных условиях. В то же время термическое воздействие ведет к пассивации твердофазового взаимодействия вследствие аннигиляции неравновесных дефектов. Уравнение, учитывающее локальные отклонения от равновесных условий как в объеме, так и на границе фаз, было предложено Тамманом и Фишбеком:
С помощью этого уравнения можно описать кинетику связывания СаО при обжиге сырьевой смеси в интервале от 1000 до 1500°С с удовлетворительной точностью. Необходимо указать на то, что оба уравнения базируются на одном и том же исходном положении: скорость твердофазовой реакции обратно пропорциональна толщине слоя продукта реакции, а также в ходе реакции идет одностороння диффузия покрываемого компонента. Однако в реальных условиях может протекать и противодиффузия реагентов через слой продукта реакции, поэтому приведенные выше кинетические уравнения не являются универсальными и, следовательно, пригодны для описания кинетики лишь отдельных твердофазовых реакций или их стадий. Большое влияние на скорость твердофазовых реакций оказывает присутствие в реакционной зоне газовой или жидкой фазы, которые сами непосредственного участия в реакции не принимают. Известно, что поверхность контакта между зернами в реальных порошках составляет лишь незначительную часть их общей поверхности. Расчеты показывают, что если не принимать во внимание поверхностную диффузию, то степень превращения твердых тел за один час массопередачи путем внутренней диффузии не должна превышать 1%. В действительности же скорость многих твердофазовых реакций, как правило, оказывается на 2-4 порядка выше, чем расчетная. Из этого вытекает, что здесь играет существенную роль поверхностная диффузия или массопередача, осуществляемая не только через контактные участки, а преимущественно за счет перехода твердого тела в жидкое или газообразное состояние и его диффузия в жидкой или газовой фазе к поверхности другого компонента. Увеличение скорости твердофазовых реакций за счет вышеуказанных факторов объясняется: - большей площадью реакционной поверхности, которая за счет омывания, обволакивания этими фазами зерен реагентов приближается к общей площади реагирующих частиц; - значительно большим значением коэффициента диффузии в газе и жидкости, в которые переходит один из реагентов, по сравнению с твердой фазой. 3.9.3. Минералообразование на стадии твердофазовых При обжиге сырьевой смеси последовательность минералообразования зависит не только от химического состава и минералогической природы отдельных компонентов. Немаловажную роль на ход фазовых превращений оказывает массоперенос в печи, неравномерность перемещения и смешивания материала, переменный состав печных газов и др. Образование новых минералов в сырьевой смеси интенсивно начинает протекать в интервале 850-900°С благодаря высокой реакционной способности СаО. Кварц, присутствующий в сырье за счет каталитического действия ионов Na+, K+, Fe3+, Al3+ и других примесей, уже при 600-1000°С переходит в высокореакционную форму - кристобалит. Примеси щелочей в сырье способствуют образованию при 600-800°С микроэвтектики (расплава), которая интенсифицирует ход «твердофазовых реакций». В большинстве случаев твердофазовые реакции являются многоступенчатыми. Так, например, в системе СаО - SiO2 синтез минералов идет последовательно следующим образом:
По иному эти превращения можно записать в виде СаО + SiO2 ® С2S ® С3S2 ® СS ® С3S. С точки зрения химии полимеров двухкальциевый силикат (ортосиликат), являющийся исходным мономером, полимеризуется по мере повышения температуры схожим образом с метаном, образующим гомогологический ряд предельных углеводородов. Аналогично ведет себя ортофосфорная кислота (исходный мономер), которая с повышением температуры подвергается поликонденсации с образованием олигомеров, а затем полимеров. Известно, что фосфаты являются кристаллохимическими аналогами силикатов, например AlPO4 и SiO2, поэтому и поведение их в процессе термообработки в определенной мере схожи. Так, двухкальциевый силикат островного строения, являясь исходным мономером, превращается последовательно в димер (дисиликат кальция), затем в полимер (метасиликат кальция) и, наконец, вследствие деструкции - в островной ортосиликат (трехкальциевый силикат). Характерно, что крайние члены в этом гомогологическом ряду (С2S и С3S) обладают вяжущими свойствами, а средние (С3S2 и СS) - нет. Последовательность протекания взаимодействия в указанной бинарной системе можно выразить графически (рис. 3.6).
Рис. 3.6. Последовательность образования соединений в смеси СаО + SiO2 (1: 1) при 1200°С: 1 - 2СаО × SiO2; 2 - 3СаО × SiO2; 3 - СаО × SiO2
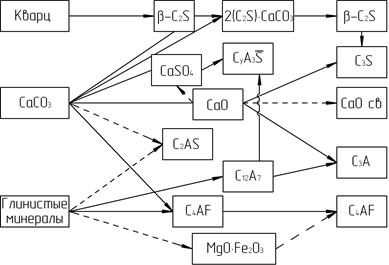
Поскольку сырьевая смесь является фактически гораздо сложнее вышеописанной двухкомпонентной, то наряду с образованием силикатов кальция при относительно низких температурах образуются также СА и СF, которые в дальнейшем переходят в более основные фазы С12А7, С3А и С2F. Следует отметить, что соединения С3А и С4AF выше 1250°С в качестве самостоятельных фаз уже не регистрируются, а появляются лишь при кристаллизации клинкерного расплава. На рис. 3.7 представлены области существования промежуточных и конечных фаз, образующихся в обжигаемой сырьевой смеси.
Рис. 3.7. Области существования фаз при обжиге сырьевых цементных шихт
Наряду с фазами, области существования которых обозначены на рис. 3.7, в обжигаемой сырьевой шихте в зависимости от минералогической природы компонентов, вида и количества примесных оксидов могут образовываться и другие промежуточные соединения или твердые растворы, которые в большинстве случаев при температурах завершения клинкерообразования распадаются. К таким промежуточным фазам относится, в частности, спуррит 2(С2S) × СаСО3, диссоциирующий при 940°С (рис. 3.8).
Рис. 3.8. Диаграмма последовательности фазовых переходов при спекании сырьевых цементных шихт Синтез трехкальциевого силиката при твердофазовом спекании протекает очень медленно. Даже при температурах 1400-1500°С образование его в отсутствие расплава чрезвычайно затруднено и требует больших затрат времени на обжиг. Основное количество алита в клинкере образуется в зоне спекания, т. е. там, где присутствует клинкерный расплав.
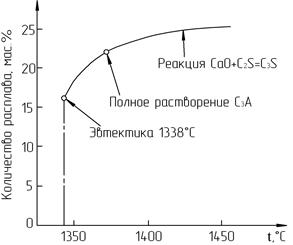
3.9.4. Минералообразование на стадии жидкофазового В зону спекания, имеющую температурные границы 1300-1450-1300°С, обжигаемый материал входит, имея следующий минералогический состав: С2S, С12А7, С3А, С2F, С4AF и непрогреагировавший (свободный) СаО. В четырехкомпонентной системе CaO - SiO2 - Al2O3 - Fe2O3 при температуре 1338°С появляется эвтектический расплав состава, мас. %: CaO - 54,8; SiO2 - 6,0; Al2O3 - 22,7; Fe2O3 - 16,5. В присутствии других оксидов, таких как MgO, R2O, SO3, P2O5, TiO2 и другие, которые попадают через сырьевые материалы, температура образования этого эвтектического расплава может снижаться до 1250-1280°С. Количество расплава (Q) в зоне спекания может быть определено по формуле Q 1338°С = 6,1 Fe2O3 + R2O + MgO + SO3 при значении глиноземного модуля р ³ 1,38. Если значение модуля р £ 1,38, то Q 1338°С = Al2O3 - 5,22 Fe2O3 + MgO + R2O + SO3. В обоих уравнениях Al2O3, Fe2O3, MgO, R2O и SO3 означают массовое процентное содержание оксидов в клинкере. С повышением температуры оксиды алюминия и железа переходят в расплав полностью, отчего его количество увеличивается (рис. 3.9). Обычно содержание расплава в зоне спекания лежит в пределах 20-25%. Полностью клинкер может расплавиться при 1750-1870°С. Механизм реакций в системе «Т - Ж» зависит от состава и строения клинкерного расплава. Причем на это оказывает влияние не только соотношение основных оксидов (СаО, SiO2, Al2O3, Fe2O3), но и примесных оксидов и соединений. Кроме того, большую роль играет и вязкость жидкой фазы, которая зависит не только от величины глиноземного модуля р, но и от значения п и КН после того, как алюминаты и алюмоферриты кальция перейдут в расплав.
Рис. 3.9. Характер изменения количества жидкой фазы в клинкере при температурах спекания
Таким образом, в клинкерном расплаве присутствуют наряду с оксидами, обладающими ярко выраженными основными свойствами (СаО), и кислотными оксидами (SiO2) амфотерные (Al2O3, Fe2O3), которые в зависимости от основности расплава могут вести себя либо как основания, диссоциируя в расплаве по схеме М2О3 ® 2М3+ + 3О2-, либо как кислоты: М2О3 + 5О2- ® 2МО Следовательно, в расплаве Al3+ и Fe3+ могут находиться как в октаэдрической, так и тетраэдрической координации по кислороду. Причем октаэдрическая координация обуславливает проявление свойств оснований, а тетраэдрическая – роль кислот. В расплаве существует равновесие между этими двумя структурными формами, что может быть выражено такой схемой: МО Как известно, вязкость расплавов определяется главным образом подвижностью сложных анионов, способных образовывать агрегаты − цепи, кольца, блоки. Из этого вытекает важный вывод: повысить вязкость расплава можно, довольно эффективно смещая равновесие в сторону образования [FeO]5− и [AlO4]5−. Наличие в расплаве тетраэдрических анионов [РО4]3− обеспечивает стабилизацию структуры расплава. Фторид кальция в количестве до 1 мас. % значительно снижает вязкость расплава, а при большем содержании, наоборот, повышает вследствие выкристаллизации из него CaF2. Фторсодержащие соли и CaCl2, кроме уменьшения вязкости, обеспечивают также снижение температуры образования расплава. Клинкерный расплав пропитывает пористые частицы СаО, С2S и других минералов, а также способствует их склеиванию за счет капиллярных сил. В контактной зоне происходит интенсивное растворение СаО и С2S, а затем их взаимодействие по реакции Лимитирующими стадиями алитообразования являются реакции на фазовых границах «расплав − СаО» и «расплав – С2S». Растворение СаО и С2S в расплаве идет не путем постепенного перехода в расплав молекулярных слоев, а за счет отсчепления от твердого тела блоков − групп молекул (109−1012) размером ~ 1 мкм, т. е. вследствие диспергирования. Следовательно, этот процесс не является чисто диффузионным. Скорость растворения 2СаО ∙ SiO2 в расплаве в 3−5 раз превышает таковую для СаО. Поскольку основной задачей для зоны спекания является достижение полного усвоения СаО, то можно сделать вывод о том, что общее время жидкоофазового спекания будет определяться временем растворения оксида кальция в расплаве. В свою очередь, скорость растворения СаО зависит от степени его дефектности и вязкости расплава. Константа скорости этой реакции возрастает с увеличением количества расплава с 10 до 30 мас. %, при замене части Al2O3 на Fe2O3 и с ростом температуры. Клинкерный расплав, помимо вышеуказанных функций, выполняет целый ряд технологических ролей. Он способствует образованию обмазки на огнеупорной футеровке в зоне спекания, что обеспечивает длительную компанию печи до 1−2 лет. Обмазка предотвращает от истирания клинкерными гранулами периклазохромитовый кирпич, исключает инфильтрацию расплава в него, снижает попадание шестивалентного хрома в клинкер. Появление расплава способствует частицам обжигаемого материала вступлению в контактное взаимодействие и сближению за счет высокого значения поверхностного натяжения (0,5−0,6 Н/м) и низкой его вязкости (0,1−0,2 Па ∙ с). Следовательно, с помощью вязкости расплава можно управлять агрегированием частиц и размером клинкерных гранул. Кроме того, на процесс агломерации влияет также колебание температуры в зоне спекания, ее протяженность, форма факела и др. Хорошая агломерация клинкерных зерен способствует нормализации условий охлаждения клинкера, снижает его пыление и возможность кольцеобразования.
|

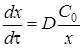 ,
,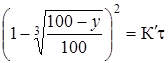 ,
, , носит прямолинейный характер, то это свидетельствует о правомерности применения данного уравнения для описания кинетики реакции.
, носит прямолинейный характер, то это свидетельствует о правомерности применения данного уравнения для описания кинетики реакции.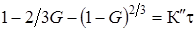 ,
, .
.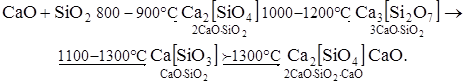


 .
.


