Энтропия идеального газа. Второй закон термодинамики. Теорема Нернста.
Формулу КПД обратимого цикла Карно можно переписать в виде
Преобразуем это равенство к другому виду
Величину, равную отношению теплоты, полученным телом при изотермическом процессе, к температуре, при которой происходит теплопередача, называют приведенной теплотой. В последнем равенстве Q означает теплоту, переданную телу нагревателем, имеющим температуру Т, Q0 – теплоту, отданную холодильнику, имеющему температуру Т0. Если условно считать, что холодильник тоже отдает телутеплоту, но теплоту со знаком “минус“ (Q0 < 0), то последнее равенство можно переписать в виде
т.е. алгебраическая сумма приведенных теплот для обратимого цикла Карно равна 0. Любой процесс, в общем случае, можно представить как результат бесконечно большого числа бесконечно малых процессов, в течение каждого из которых передача теплоты ΔQ (если процесс не адиабатный) происходит при постоянной температуре Т. Для каждого такого элементарного процесса приведенная теплота равна
В пределе эта сумма представляет собой интеграл по замкнутому контуру, который равен нулю.
Такой интеграл равен нулю в том случае, если подынтегральное выражение является полным дифференциалом dS некоторой функции S. В рассматриваемом случае эта функция называется энтропией.
Основное свойство энтропии – она (подобно внутренней энергии) является однозначной функцией состояния, т.е. каждому состоянию тела соответствует одно определенное значение энтропии. Если система в процессе изменения состояния перешла из состояния 1 в состояние 2, то изменение энтропии ΔS, будет равно
Очевидно, что для кругового процесса, когда начальное 1 и конечное 2 состояния совпадают, S2 = S1 и ΔS = 0, т.е. в круговом процессе энтропия системы не изменяется. Для необратимого процесса
Объединяя эти выражения для обратимого и необратимого процессов, можно записать
т.е. сумма приведенных теплот для любого цикла не может быть больше нуля (неравенство Клаузиуса). Обобщая неравенство на любой круговой процесс (обратимый и необратимый), можно записать
Знак “–” относится к обратимым процессам, а знак “< “ – к необратимым. Поскольку для необратимого процесса в замкнутой системе (теплота в нее не поступает и из нее не уходит, т.е. δQ = 0) выполняется неравенство
то Таким образом, при необратимых процессах в замкнутой (изолированной) системе энтропия возрастает. Для произвольного (обратимого и необратимого) процесса в изолированной системе Первый закон термодинамики, как известно, является законом сохранения энергии в тепловых процессах и дает количественные соотношения теплоты, внутренней энергии и работы, не говоря ничего о направлении протекания процессов. Второй закон термодинамики определяет направление протекания процессов. С введением понятия энтропии о направлениях протекания процессов можно судить по ее изменениям. Изменение энтропии изолированной системы выражается так S2 – S1 ≥ 0, Таким образом, при обратимом процессе энтропия не изменяется (S2 – S1 = 0), а при необратимом она возрастает (S2 – S1 > 0). Все реальные тепловые процессы, протекающие в замкнутой системе, необратимы, т.е. часть энергии при протекании этих процессов рассеивается, вследствие чего энтропия системы возрастает. Из сказанного можно сделать заключение: 1. Изменение энтропии замкнутой системы при необратимых процессах может служить мерой рассеяния энергии в таких процессах. 2. По изменению энтропии можно судить о направлении протекания процессов. Второй закон термодинамики определяет направление процессов. В частности, все естественные процессы протекают в сторону возрастания энтропии. Существует несколько формулировок 2-го закона термодинамики. Ниже приведены две из них.
|


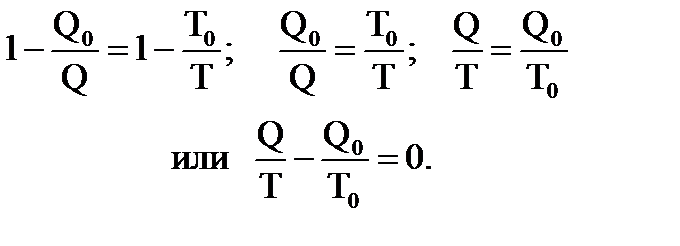 (1)
(1)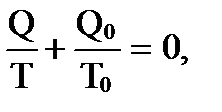
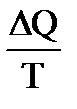 , а для цикла сумма приведенных теплот будет равна 0.
, а для цикла сумма приведенных теплот будет равна 0.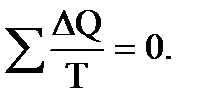

 .
.

 и после преобразования аналогичного преобразованию (1), получим
и после преобразования аналогичного преобразованию (1), получим
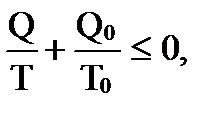
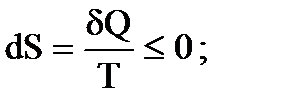
 =∮dS ≤ 0.
=∮dS ≤ 0.
 , а это значит, что S2 > S1.
, а это значит, что S2 > S1. , т.е. энтропия изолированной системы при любых происходящих в ней изменениях не может убывать.
, т.е. энтропия изолированной системы при любых происходящих в ней изменениях не может убывать.


