Глава 11. Реальные газы
Поведение реальных газов довольно хорошо описывается уравнением состояния Менделеева-Клапейрона для идеальных газов
при не слишком высоких давлениях и достаточно высоких температурах. Вывод этого уравнения основан на 3-х существенных предположениях: 1. Между молекулами отсутствуют силы взаимодействия, т.е. молекулы газа взаимодействуют друг с другом только в момент столкновения. 2. Размеры молекул пренебрежимо малы и собственный объем молекул очень мал по сравнению с объемом сосуда, в котором находится газ. 3. Молекулы при столкновениях со стенками сосуда и между собой взаимодействуют как упругие шары. При повышении давления и уменьшении температуры наблюдаются значительные отступления от уравнения (1). По оценкам размер молекулы имеет величину порядка 10-8см.Принимая радиус молекулы r≅ 10-8 см, ее объем будет V1 В 1 см3 при нормальных условиях содержится Если же давление составит 5000 атм, то объем молекул составит 0,5 см3. Таким объемом пренебречь нельзя и на объем, занимаемый самими молекулами, необходимо вносить поправку в уравнение состояния газа. Какого вида поправку – будет сказано ниже.
|

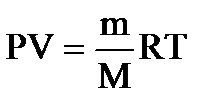 (1)
(1) 4∙10-24 cм3.
4∙10-24 cм3. 2,7∙1019 молекул. Объем, занимаемый непосредственно самими молекулами, будет V=4∙10-24∙2,7∙1019
2,7∙1019 молекул. Объем, занимаемый непосредственно самими молекулами, будет V=4∙10-24∙2,7∙1019  10-4 см3 и им можно пренебречь.
10-4 см3 и им можно пренебречь.


