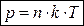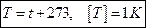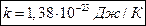Идеальный газ. Основное уравнение МКТ идеального газа.
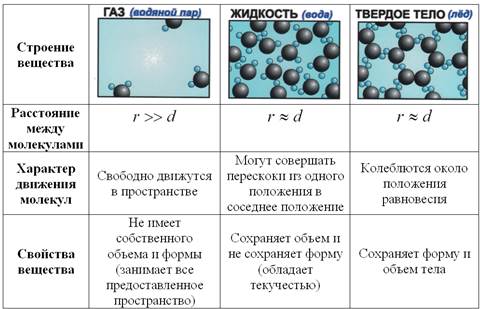
Строение и свойства веществ в разных агрегатных состояниях
Основные понятия молекулярно-кинетической теории вещества Массу частиц вещества (атомов и молекул) удобнее выражать в атомных единицах массы (а.е.м.).
Количество вещества n логичнее было бы выражать числом частиц, содержащихся в веществе. Т.к. число молекул (или атомов) в веществе огромно, принято количество вещества выражать в молях ([n] = 1 моль).
1 моль – это количество вещества, в котором содержится столько же молекул (или атомов), сколько их содержится в 0,012 кг углерода-12.
Дополнительные расчетные формулы: Количество вещества может быть определено по формулам:
Число молекул в веществе: Масса одной молекулы(атома) вещества:
Идеальный газ. Основное уравнение МКТ идеального газа. Идеальный газ – это модель реального газа, в которой пренебрегают силами притяжения и отталкивания между молекулами, а взаимодействие между ними осуществляется только посредством упругих соударений вследствие теплового движения.
Средняя кинетическая энергия молекул идеального газа: Отсюда:
Связь средней кинетической энергии молекул с температурой: Отсюда:
Постоянная Больцмана: Абсолютная температура:
Средняя квадратичная скорость:
|


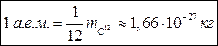 За атомную единицу массы принята
За атомную единицу массы принята  часть массы атома углерода-12.
часть массы атома углерода-12.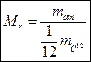 Относительная молекулярная (атомная) масса вещества
Относительная молекулярная (атомная) масса вещества  – это масса 1 молекулы (атома) вещества, выраженная в атомных единицах массы. (Находится по периодической таблице химических элементов)
– это масса 1 молекулы (атома) вещества, выраженная в атомных единицах массы. (Находится по периодической таблице химических элементов) В одном моле любого вещества содержится одно и тоже число частиц, которое называют числом Авогадро NA.
В одном моле любого вещества содержится одно и тоже число частиц, которое называют числом Авогадро NA.
 Молярная масса М – это масса одного моля вещества.
Молярная масса М – это масса одного моля вещества. Связь молярной массы с относительной молекулярной (атомной массой)
Связь молярной массы с относительной молекулярной (атомной массой)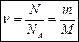
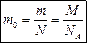
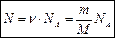

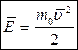
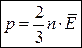
 Основное уравнение МКТ идеального газа устанавливает связь между характеристиками молекул (атомов) газа (массой, концентрацией, средней квадратичной скоростью частиц) и давлением, производимым этим газом на стенки сосуда.
Основное уравнение МКТ идеального газа устанавливает связь между характеристиками молекул (атомов) газа (массой, концентрацией, средней квадратичной скоростью частиц) и давлением, производимым этим газом на стенки сосуда.